自“魔法子弹”学说提出以来,ADC药物越发成为抗体药物研发的热点。目前已经有14款ADC药物被FDA批准上市。2022年ASCO披露了多项ADC药物的临床试验结果,其中DS-8201“与化疗相比,在患有HR阳性和HR阴性的HER2低转移性乳腺癌患者中,Enhertu将疾病进展或死亡的风险降低了50%”,赢得了全世界的广泛关注。
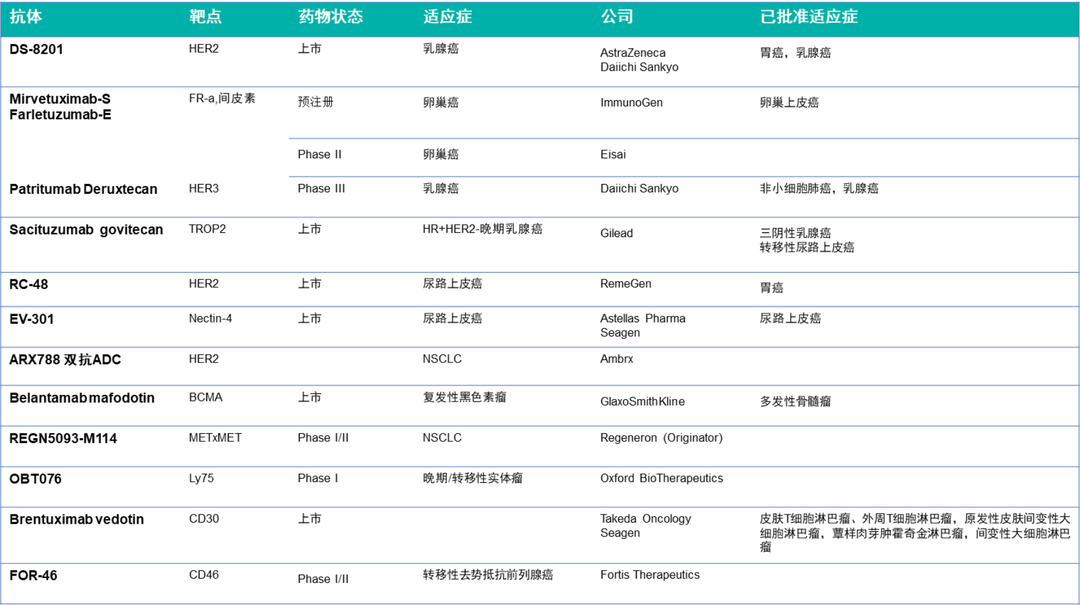
表1. ADC药物在2022年ASCO公布的进展小结
ADC药物的主要组分可以分为抗体、接头和有效载荷。ADC药物的临床特性取决于这三个成分的特征。抗体具有特异性的优势,可以特异性结合到肿瘤表达的抗原,其中热门实体瘤靶点包括HER2、TROP2、Nectin-4、EGFR,血液瘤靶点包括CD19、CD22、CD33、CD30、BCMA和CD79b,如图1。接头连接的有效载荷可以选择性直接杀伤肿瘤细胞,有些ADC药物可以通过旁观者效应,对不表达抗原的肿瘤细胞进行杀伤,达到消退肿瘤的目的。
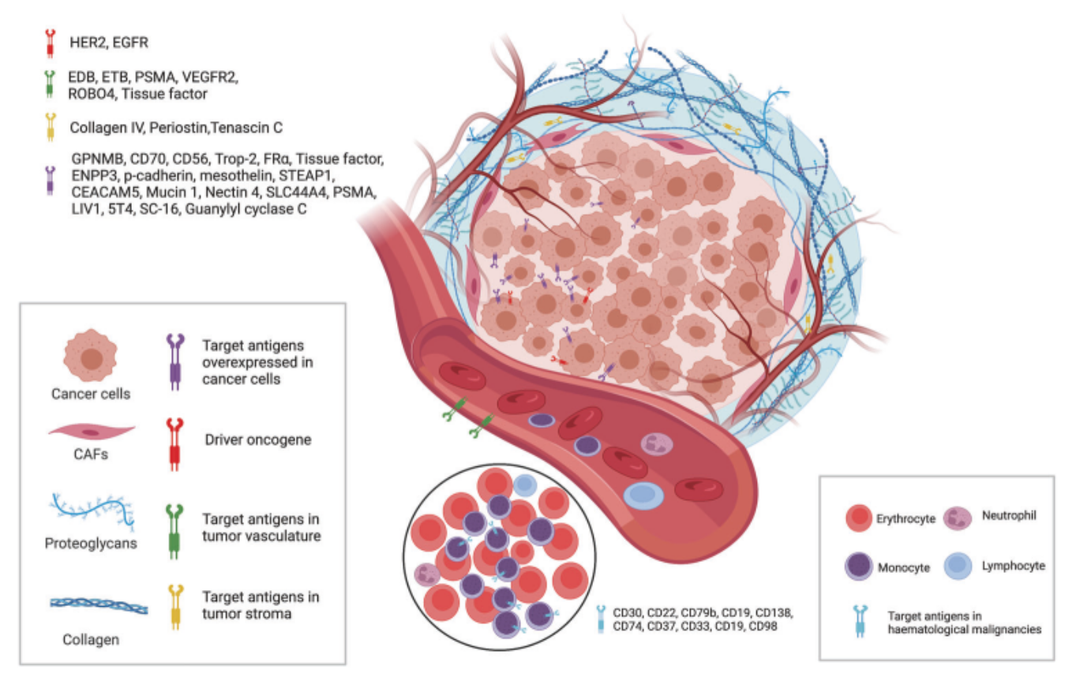
图1. 用于ADC药物研发的肿瘤细胞表面与肿瘤微环境(血管或肿瘤基质)相关抗原示意图[1]
ADC药物的临床前评价基于ADC组成部分进行实验设计。主要是基于ADC药物本身靶点特性(Fab段)、抗体亚型(Fc段功能)、接头与载荷(肿瘤细胞杀伤能力)的评估。
基于ADC药物Fab段功能的药效评价
百奥赛图药效资源数据库具有上百种人源肿瘤细胞系的RNA Seq数据,表2列出了常用细胞系的热门靶点组学数据。通过组学数据进行初步筛选、流式检测确证细胞系的靶点蛋白表达情况,选择合适的细胞系进行体内、体外药效评价。
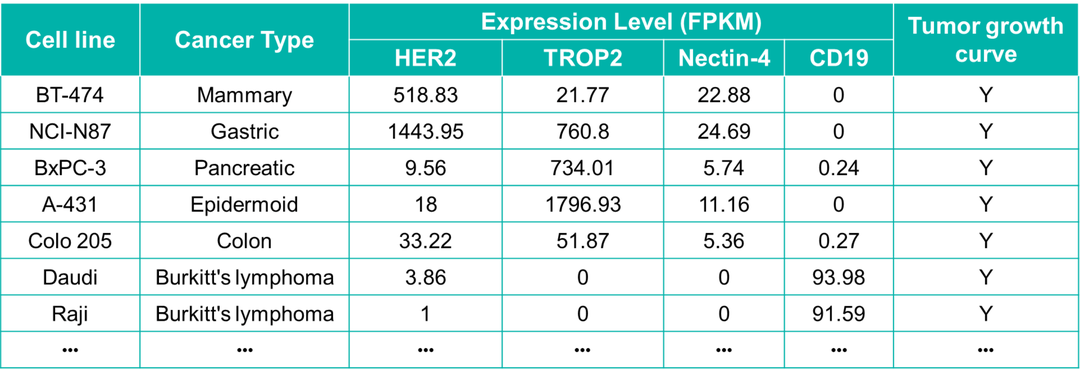
表2. 热门靶点的组学数据与成瘤情况
选择不同表达水平的细胞系,可以用于筛选候选分子的结合情况,如图2,对于HER2靶点,Disitamb Vedotin(RC-48)和Trastuzumab(曲妥珠单抗)在BT-474和NCI-N87细胞上的亲和力高于MCF-7、A431和SNU-5细胞系。
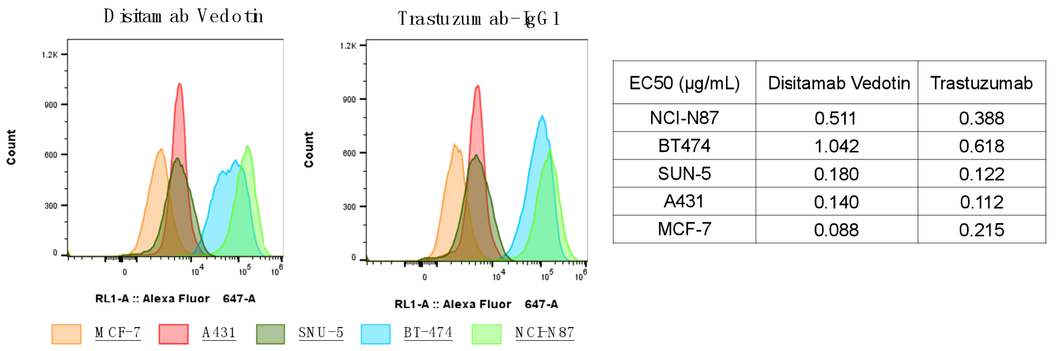
图2. 基于FACS的抗体结合情况
当ADC药物与特异性表达靶点抗原的肿瘤细胞结合后,ADC药物被细胞内吞,以早期内涵体的形式存在,内涵体进而成熟并与溶酶体融合。细胞毒性的载荷通过化学或者酶裂解在溶酶体中释放,载荷靶向DNA或者微管蛋白,最终导致细胞凋亡。用PH敏感的染料对抗体进行荧光标记,这样当药物进入内涵体后会释放染料进而发光。采用Incucyte对细胞摄取抗体进行实时成像与数据采集,可以比较不同ADC药物随着孵育时间的延长在不同细胞系上的内吞情况,进而筛选得到最优候选分子。如图3,将NCI-N87、MCF-7和BT-474细胞与pH敏感染料标记的RC-48或曲妥珠单抗孵育24小时,并对孵育细胞连续观察。图3B与3C纵坐标表示细胞内化抗体的信号强度。图3D图片中的橙色信号表明抗体已内化。RC-48和曲妥珠单抗均以时间依赖性方式内化到NCI-N87和BT-474细胞中,而在MCF-7细胞中内吞信号则很弱。
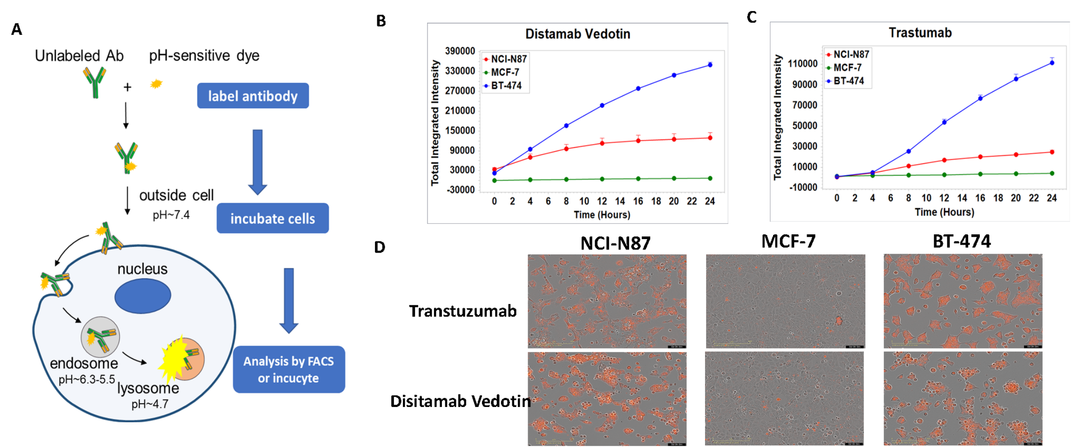
图3. RC-48与曲妥珠单抗的体外内吞实验
基于载荷相关毒性的评价
细胞毒性评价
在进行体内药效评估之前,必须全面评估其体外细胞毒性。ADC药物的细胞毒性评价可以采用对细胞活力的测定,如Presto Blue、LDH、CCK8等方法,也可以通过细胞凋亡测定或者进行细胞周期分析。在NCI-N87或MCF-7细胞中给与不同浓度的曲妥珠单抗、Enhertu或RC-48。孵育过程采用Incucyte对细胞状态进行动态监测,记录细胞的汇合比例,如图4所示。Enhertu和RC-48以浓度依赖性方式显著抑制了NCI-N87的增殖,而曲妥珠单抗并没有显示杀伤能力。三种受试品均不能抑制MCF-7的增殖,这与MCF-7的HER2表达非常低相印证。图4C和4D不同浓度的曲妥珠单抗或RC-48处理BT-474或MCF-7细胞72h。用Sartorius IncuCyte Caspase-3/7 red凋亡试剂检测细胞凋亡,红色信号表示激活Caspase 3/7。RC-48(中剂量或高剂量)显著促进BT-474细胞凋亡,而曲妥珠单抗则没有。同样,在处理过的MCF-7细胞上未观察到凋亡。
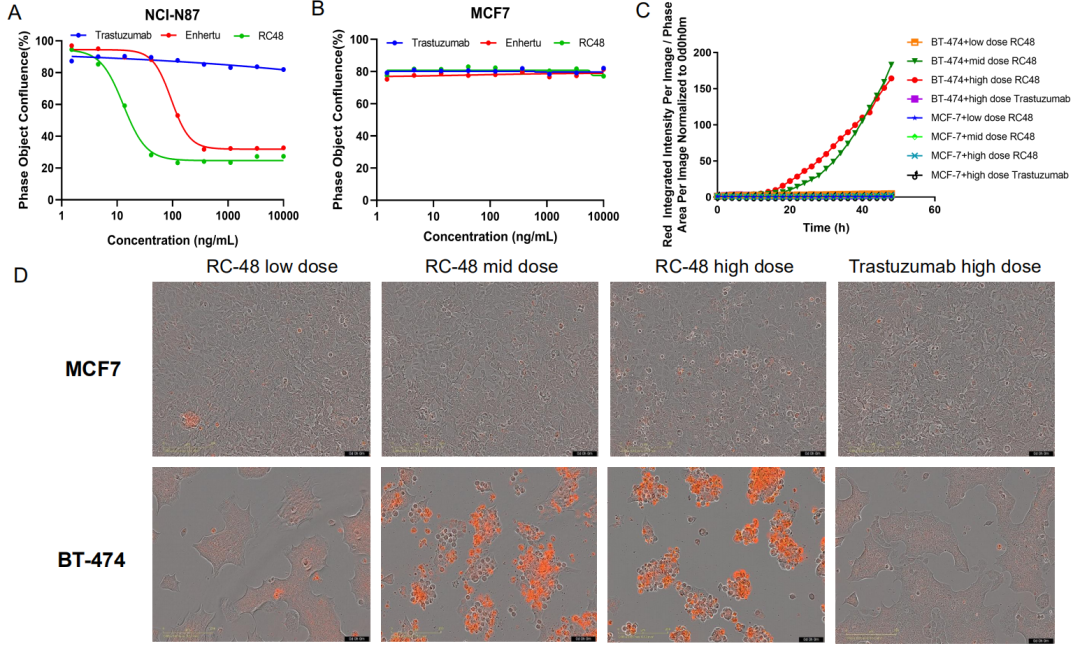
图4. 体外细胞增殖和凋亡试验,以评估有效载荷效应
旁观者效应
部分ADC药物的载荷在释放后可以渗透穿过细胞膜,进而杀伤表达抗原的肿瘤细胞周围组织,形成旁观者效应。由于肿瘤的异质性,不是所有肿瘤细胞都有ADC药物靶点的表达,旁观者效应在肿瘤治疗中有非常重要的价值,大量的临床试验也开始关注旁观者效应。
体外评价方面,将抗原高表达细胞系与抗原表达阴性的细胞系进行混合培养,采用流式检测方法检测ADC药物不表达细胞系的杀伤情况,可以评价旁观者效应。如图5,将MDA-MB-468细胞(Her2阴性)和BT474细胞(Her2阳性)共培养过夜。用RC-48或溶媒处理5天后,通过细胞计数器和流式细胞仪分别测定HER2阳性和HER2阴性细胞的数量和比率。RC-48对BT474细胞有很强的杀瘤作用,而对MDA-MB-468细胞几乎没有细胞毒性。流式结果分析表明,当与Her2阳性细胞共培养时,RC-48也能杀死MDA-MB-468细胞。
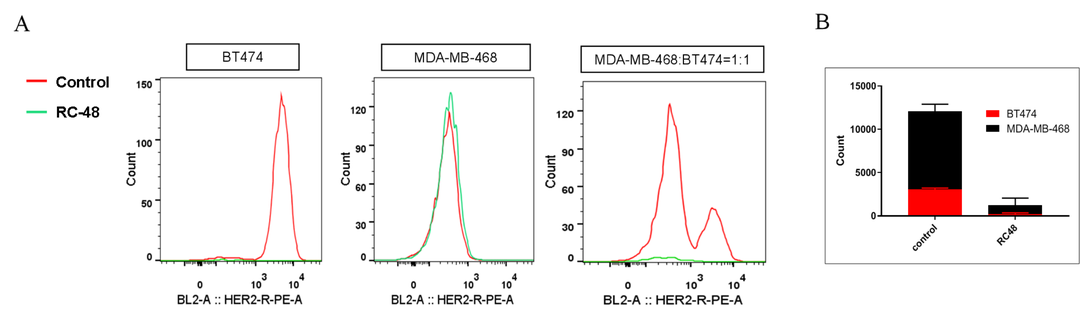
图5. MDA-MB-468细胞(Her2阴性)和BT474细胞(Her2阳性)体外共培养条件下RC-48的旁观者杀伤效应测定。
体内实验设计上,可以采用转染luciferase的不表达抗原的细胞系与高表达抗原肿瘤细胞系共同接种在免疫缺陷小鼠上进行药效评估,监测荧光信号与肿瘤体积的变化,可以评价ADC药物旁观者效应水平。
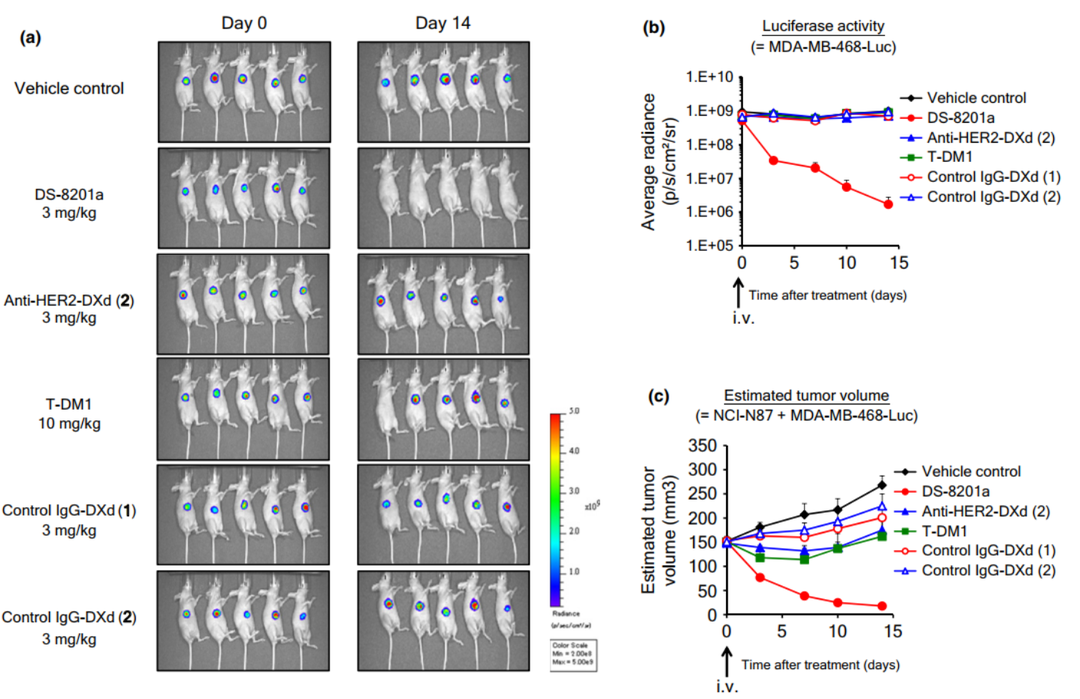
图6. DS-8201a在NCI-N87(HER2+)和MDA-MB-468(HER2-)混合接种的CDX模型中的旁观者效应[2]
采用不同抗原表达水平的细胞系验证ADC药物的体内药效水平。如图7,在皮下接种了BT474和NCI-H1975的B-NDG小鼠肿瘤模型中,所有受试品ADC对肿瘤生长均表现出明显的抑制作用。在A431肿瘤模型中的抑制作用相对较弱,这与A431细胞上HER2的低表达水平相一致。
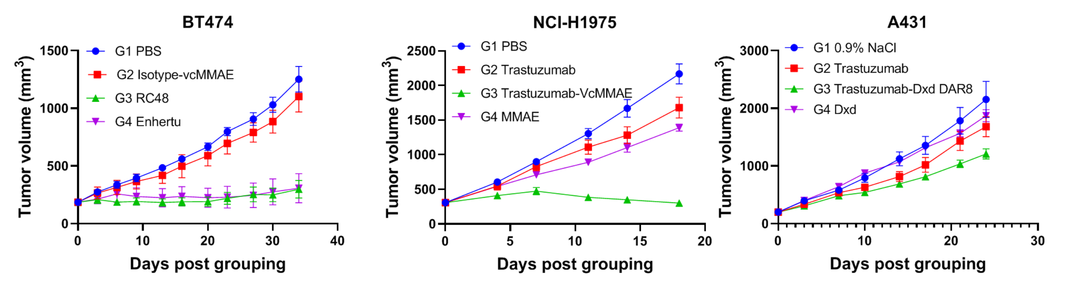
图7.ADC药物在几种CDX模型中的体内抗肿瘤疗效研究
原位肿瘤模型具备肿瘤原发位点的典型特征,模拟人肿瘤形态学、生长发展及转移特性,具有高度的临床相关性,能准确预测药效、降低假阳性发生率,更好地评估ADC药物的药效。如图8,采用胰腺癌细胞系MIA-Paca进行原位模型接种,给与HER2-ADC药物后,给药组肿瘤生长得到明显抑制。
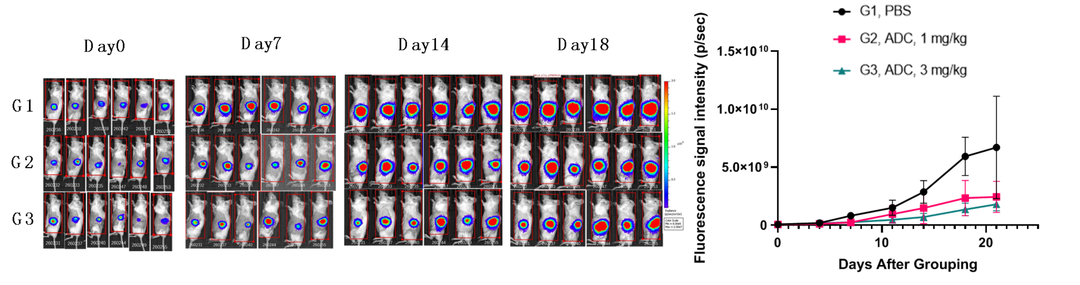
图8. ADC药物在小鼠胰腺癌原位模型上的抗肿瘤药效评价
基于ADC药物Fc段功能的药效评价
不同抗体亚型的药效机制不同,可以基于抗体Fc段的功能进行机制评价。例如ADCC效应、ADCP效应与CDC效应。表3对ADC药物的体内与体外药效评价进行了总结。
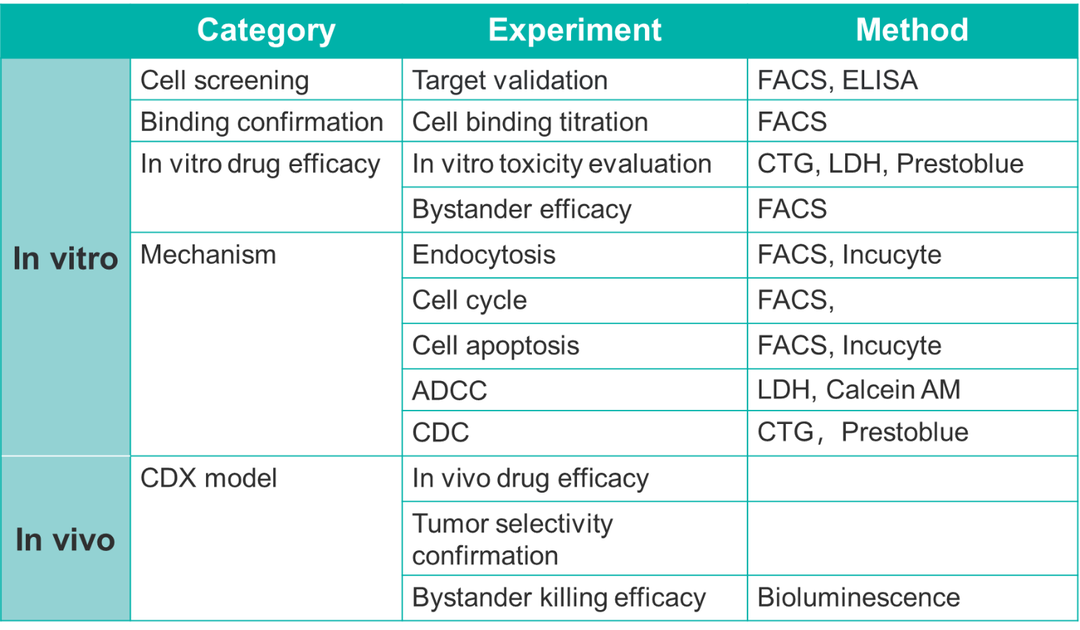
表3. ADC药物体外药效学评价的内容概览
新一代ADC药物包括靶向突变蛋白ADC、筛选非内化ADC、多种载荷ADC和双抗ADC等形式,根据其作用机制可以选择不同的药效评价模型进行临床前药效评估。随着研究热度的升高,临床试验取得的不断进展,ADC药物在肿瘤领域的下一个突破性进展指日可待。
欲获取完整版百奥赛图ADC临床前评价平台介绍,微信关注“BioMice百奥动物”公众号并回复关键字“ADC平台”,即可获取!
参考文献
[1] Zhiwen Fu , Shijun Li, Sifei Han, Chen Shi,Yu Zhang. Antibody drug conjugate: the "biological missile" for targeted cancer therapy. Signal Transduct Target Ther. 2022 Mar 22;7(1):93.
[2] Ogitani Y, Hagihara K, Oitate M, Naito H, Agatsuma T. Bystander killing effect of DS-8201a, a novel anti-human epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity. Cancer Sci. 2016 Jul;107(7):1039-46.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn