自“细胞囊泡运输的调节机制在2013年获得诺贝尔生理或医学奖后,外泌体(Exosomes)逐步成为全球生物医学领域研究的热门话题!
所有细胞,原核生物和真核生物,均会释放胞外囊泡Extracellular Vesicles (EVs)。EVs大致可分为ectosomes和exosomes两类外泌体。ectosomes是通过向外出芽夹在质膜表面的囊泡,包括微囊泡、微粒和直径约为50 nm~1 mm的大囊泡。exosomes是直径范围约为40至160 nm(平均约100 nm)的EV,具有内泌体来源。外泌体,可以包含细胞的许多成分,包括DNA、RNA、脂质、代谢物以及胞质和细胞表面蛋白。细胞生成外泌体的生理目的推测是外泌体可能从细胞中清除过量和/或不必要的成分,以维持细胞内稳态。
外泌体与免疫反应、病毒致病性、妊娠、心血管疾病、中枢神经系统相关疾病和癌症进展有关。外泌体递送到受体细胞的蛋白质、代谢产物和核酸有效地改变了它们的生物学反应。这种外泌体介导的反应可能是疾病促进或抑制。外泌体在调节复杂的细胞内通路中的内在特性推进了其在许多疾病的治疗控制中的潜在效用,包括神经退行性疾病和癌症。外泌体可以被改造成递送不同的治疗有效负荷,包括短干扰RNA、反义寡核苷酸、化疗药物和免疫球蛋白。外泌体的脂质和蛋白质组成可影响其药代动力学特性,其天然成分可能在增强生物利用度和最小化不良反应中发挥作用。外泌体除了具有治疗潜力外,还具有帮助疾病诊断的潜力。它们在所有的生物体液中都有报道,通过生物体液的采样(液体活检)很容易获得外泌体复杂物质的组成。基于外泌体的液体活检突出了其在诊断和确定癌症和其他疾病患者预后方面的潜在效用。疾病进展和治疗反应也可以通过外泌体的多组分分析来确定。
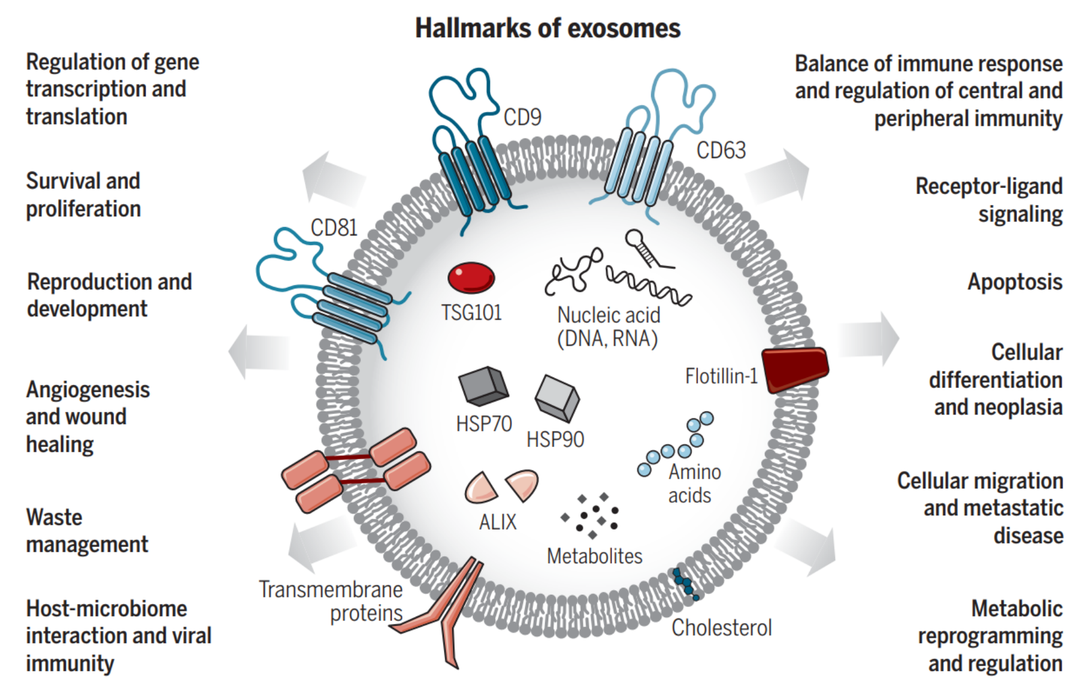
图1. 外泌体功能和特征[1]
外泌体的生物合成
外泌体的产生过程涉及质膜的双重内陷和含有腔内囊泡intraluminal vesicles (ILVs)的细胞内多泡体multivesicular bodies (MVBs)的形成。ILV最终通过质膜的损伤和MVB胞吐作用以直径范围约为40-160 nm的外泌体形式分泌(图2)。1).质膜的第一次内陷形成杯状结构,包括细胞表面蛋白和与细胞外环境相关的可溶性蛋白(图2)。2).这导致了早期分选内体early-sorting endosome (ESE)的新生形成,在某些情况下可能直接与预先存在的ESE合并[1]。

图2.细胞外囊泡和外泌体的同一性和异质性[1]
ESEs可以成熟为晚期分选内体late-sorting endosomes (LSEs),最终生成MVBs,也称为多囊泡内体。MVBs由胞内体界膜向内内陷(即质膜双重内陷)形成。这一过程导致MVB含有几种ILV(未来的外泌体)。MVB既可以与溶酶体或自噬体融合降解,也可以与质膜融合释放所含的ILV作为外泌体。根据外泌体数据库的最新更新列表[2],包含9769个蛋白质、3408个mRNA、2838个miRNA和1116个脂质。外泌体的这些内容物可作为癌症进展的预后标志物和(或)分级依据。同时调节肿瘤生长、转移、血管生成,介导肿瘤细胞耐药(图3)。
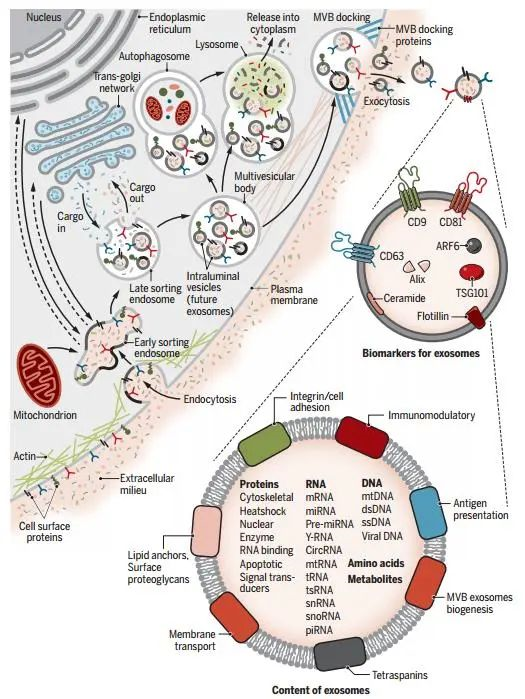
图3.外泌体的生物合成及其内容[1]
外泌体的异质性
外泌体的异质性包括:大小异质性、含量异质性、功能异质性和细胞来源异质性(图2)。
尺寸不等可能是由于MVB界膜内陷不均匀,导致液体和固体的总含量不同,外泌体可能包含由不同大小范围定义的亚群。大小异质性也会导致不同量的外泌体含量;微环境和细胞固有的生物学可能影响外泌体的含量及其生物学标志物。外泌体可含有膜蛋白、胞质和核蛋白、细胞外基质蛋白、代谢产物和核酸,即mRNA、非编码RNA种类和DNA;外泌体对受体细胞的影响可以不同,因为它们的细胞表面受体表达各不相同,这样的功能性有不同的表现,1. 诱导细胞存活,2. 诱导细胞凋亡,3. 诱导免疫调节等(图2);异质性也可以基于外泌体的起源器官和组织,包括它们是否来自癌细胞,使它们具有独特的特性,如对某些器官的趋向性和特定细胞类型的摄取。
所有这些特征的组合将有可能引起更高阶的复杂性和外泌体的异质性。
外泌体与肿瘤免疫
外泌体DNA在免疫反应中的作用也被证明与癌症进展相关。外泌体引起的适应性免疫应答包括树突状细胞活化伴乳腺癌细胞来源的外泌体基因组DNA摄取、cGAS-STING信号活化和小鼠抗肿瘤应答。在体外,T细胞接触后,树突状细胞的启动(改变树突状细胞活性以增强其对未来刺激反应的免疫指令)也与T细胞外泌体基因组和线粒体DNA (mtDNA)的摄取有关,通过cGAS-STING信号诱导I型IFN的产生。
在癌症背景下,这种外泌体DNA脱落可能是有益的,这样抑制癌细胞中的EGFR导致这些细胞外泌体中的DNA增加,并且可以诱导树突状细胞中的cGAS-STING信号,有助于整体抑制肿瘤生长。相比之下,肿瘤外泌体DNA对炎症反应的影响可间接恶化癌症,循环中性粒细胞摄取肿瘤源性外泌体DNA可增强组织因子和IL-8的产生,后者在促进肿瘤炎症和副肿瘤事件(血栓形成)中发挥作用。
外泌体也可能通过影响受体细胞中的基因表达和信号通路来调节免疫反应,主要是通过miRNA的转移。外泌体miRNA可以在树突状细胞之间交换并抑制基因表达,这种外泌体介导的细胞间通讯可能影响树突状细胞成熟。肿瘤来源的外泌体如miR-212-3p会下调树突状细胞中的MHC-II转录因子RFXAP(调节因子X相关蛋白),可能促进癌细胞的免疫逃避。肿瘤来源的外泌体mir222-3p会下调单核细胞中的SOCS3(细胞因子信号传导抑制因子3),从而促进STAT3介导的M2极化的巨噬细胞,可能产生免疫抑制微环境。
外泌体对免疫应答的调节也可能涉及免疫调节分子的呈递,如PD-L1(程序性细胞死亡配体1)和FasL(Fas细胞表面死亡受体配体)。黑色素瘤来源的外泌体上的PD-L1在体内抑制CD8 + T细胞抗肿瘤功能,癌细胞来源的外泌体以PD-L1依赖的方式阻断树突状细胞成熟和迁移。此外,癌细胞来源的PD-L1 + 外泌体促进荷瘤小鼠引流淋巴结中T细胞耗竭,促进肿瘤生长。黑色素瘤或前列腺癌来源的外泌体上的FasL诱导Fas依赖性T细胞凋亡。除外泌体外,配体介导的T细胞信号传导和与表达CD39(三磷酸外切核苷二磷酸水解酶1)和CD73 (5′nuleotidase)的多种人类癌细胞类型来源的外泌体相关的酶活性导致T细胞中5′AMP转化为腺苷和腺苷信号传导,在体外有效限制其活化。这些作用最终可能抑制适应性免疫应答。相比之下,肥大细胞来源的外泌体在体外和体内表达MHC-Ⅱ、CD86、LFA-1(淋巴细胞功能相关抗原1)和ICAM-1(细胞间粘附分子1),诱导B细胞和T细胞的增殖。最后,癌细胞来源的外泌体被改造为过表达CD40L(CD40配体或CD154,T细胞上的共刺激分子,与APC上的CD40结合),促进树突状细胞成熟,导致体内T细胞增殖和抗肿瘤活性增加。
外泌体在癌症先天性免疫反应中的作用也有报道。来自胰腺癌细胞和胰腺癌患者血浆的外泌体通过作为诱饵限制补体介导的裂解,从而降低对癌细胞的细胞毒性。外泌体HSP72(热休克蛋白70 kDa蛋白1)可通过STAT3触发髓源性抑制细胞活化,胶质母细胞瘤干细胞来源的外泌体诱导STAT3介导的巨噬细胞表型免疫抑制(M2型)转换,这将限制肿瘤微环境中的抗肿瘤免疫反应。来自癌细胞的外泌体miR-21和miR-29a触发巨噬细胞中人TLR8和小鼠TLR7介导的NF-kB(核因子-kB)活化以及IL-6和TNF-a的产生促进小鼠黑色素瘤肺转移和肺癌。(图4)

图4.肿瘤微环境中外泌体的信号转导途径[4]
神经退行性疾病
外泌体生物发生和神经元细胞中分泌囊泡调节之间的交集为外泌体与神经退行性疾病发病机制之间的假定联系提供了新的认识。外泌体可能促进或限制未折叠和异常折叠蛋白在大脑中的聚集。外泌体可以参与对错误折叠蛋白的清除,从而发挥解毒和神经保护功能,或参与错误折叠蛋白的繁殖和聚集,有效促进蛋白聚集体的“传染性”,有助于疾病进展。外泌体的这种相反功能可能并不相互排斥,现介绍如下。
使用GW4869(抑制MVB向内出芽)进行药理学阻断或使用莫能菌素(增加细胞内Ca2 + 和MVB生成)增强外泌体生成,分别导致感染性朊蛋白PrPsc的传递减少或增加,这与体外Creutzfeldt–Jakob病相关。Tau和Ab(淀粉样前体蛋白[APP]裂解产生的b-淀粉样蛋白)均与阿尔茨海默病有关,存在于外泌体中,包括患者脑脊液来源的外泌体(Tau)、小鼠小胶质细胞培养上清来源的外泌体(Tau)、以及小鼠和人细胞系(Ab)培养物上清液的外泌体。在体外和体内观察到外泌体对Tau聚集的病理性传播。
外泌体生物发生机制也可能具有神经保护作用。外泌体可能损害神经毒性低聚物的形成或外泌体可能将其携带出细胞。最近,工程化过表达APP的小鼠大脑外泌体分泌Ab与毒性淀粉样蛋白的启动和繁殖有关。这一过程涉及ECE1/2(内皮素转换酶1/2)的失调,有效地导致APP转基因小鼠大脑外泌体中寡聚化Ab的增加。
在不同的蛋白病(proteinopathies)如帕金森病(PD)和肌萎缩侧索硬化(ALS)中也观察到了类似的结果。
尽管外泌体在神经退行性疾病中的功能集中在外泌体控制错误折叠的蛋白质积累,核酸和其他成分可能与恶化或改善其他神经系统疾病有关。在一项评估孤独症谱系障碍(ASD)儿童血清来源的外泌体的研究中,mtDNA外泌体物质不正确地分泌小胶质细胞IL-1b,可能诱发ASD相关的炎症。外泌体在神经退行性疾病和ASD病理生理学中的作用需要更多的研究,但这并没有阻碍将其用于治疗开发的努力。这种努力在很大程度上受到外泌体有效通过血脑屏障的内在特性的鼓励,血脑屏障是一种血管网络,作为选择性过滤器,防止药物或毒素到达大脑。
外泌体的临床应用
外泌体在疾病中的生物学中的作用不断被发现,同时阐述其在各种病理诊断和治疗中的效用的研究数量也大幅增加。这利用了外泌体分泌的复杂物质,允许疾病检测和监测的多组分诊断窗口。外泌体在将功能性货物递送到病变细胞中的特性也有利于其作为治疗载体,无论是在基础水平还是应用水平。
诊断检测
外泌体在所有生物体液中都有发现,并由所有细胞分泌,使其作为微创液体活检具有吸引力,有可能纵向采样跟踪疾病进展。外泌体生物发生能够捕获复杂的细胞外和细胞内分子货物,用于全面的、多参数的诊断检测(图3)。外泌体上的表面蛋白也有利于其免疫捕获和富集。一直以来,外泌体诊断应用重点的疾病包括CVDs、影响中枢神经系统(CNS)的疾病和癌症。这种努力正在迅速扩展到涉及肝脏、肾脏和肺的其他疾病。
研究认为,在外泌体中可以发现少量的DNA,这种DNA可以对检测血清外泌体中癌症相关突变有价值,外泌体中特定的miRNA或miRNA组可能在癌症的检测中提供诊断或预后潜力。外泌体中的致癌和抑癌miRNA可能具有较高的诊断价值,因为它们在癌细胞和正常细胞之间的差异表达,可能增强它们在早期诊断中的有用性,致癌Kras被报道在外泌体中差异富集miR-100,循环中外泌体miR-21升高与胶质母细胞瘤和胰腺癌、结直肠癌、结肠癌、肝癌、乳腺癌、卵巢癌和食管癌相关,尿源性外泌体miR-21升高与膀胱癌和前列腺癌相关。其他与多种癌症类型相关的外泌体致癌microRNA包括miR-155、miR-17-92簇和miR-1246。在脑、胰腺、结直肠、结肠、肝脏、乳腺、前列腺和食管癌;口腔鳞状细胞癌;以及淋巴瘤和白血病中观察到上调。肿瘤抑制miRNA,包括miR-146a和miR-34a,与肝脏、乳腺、结肠、胰腺和血液恶性肿瘤相关。
疾病治疗
外泌体作为药物或作为药物递送载体的治疗潜力正在被积极的探索(图3)。与脂质体相比,注射的外泌体可有效进入其他细胞,并可在小鼠外源性给药后以最小的免疫清除递送功能性分子。此外,外泌体的治疗应用前景广阔,因为它们已被证实耐受性良好。来源于间充质细胞及上皮细胞的外泌体在小鼠中重复注射时不会诱导毒性。MSC来源的外泌体已被提出是治疗本身,使用MSC来源的外泌体治疗移植物抗宿主病患者表明,重复注射耐受性良好,没有实质性副作用,未引起患者反应。
基于其表面配体呈递富集,外泌体也可能使受体介导的组织靶向的发展成为可能。工程化外泌体上的配体富集也可用于诱导或抑制受体细胞中的信号事件或将外泌体靶向特定的细胞类型。例如,整合素特异性RGD(R,精氨酸;G,甘氨酸;D,天冬氨酸)修饰的肽(修饰的肿瘤归巢肽序列,作为整合素的识别序列)对未成熟树突状细胞来源的外泌体负载多柔比星,在乳腺荷瘤小鼠中显示治疗反应。其他化疗化合物也被装载到外泌体中进行癌症治疗,并在小鼠中进行了测试,并报道了抗肿瘤疗效和降低毒性。例如,巨噬细胞来源的外泌体负载紫杉醇诱导小鼠肺肿瘤反应[3]。(图5)
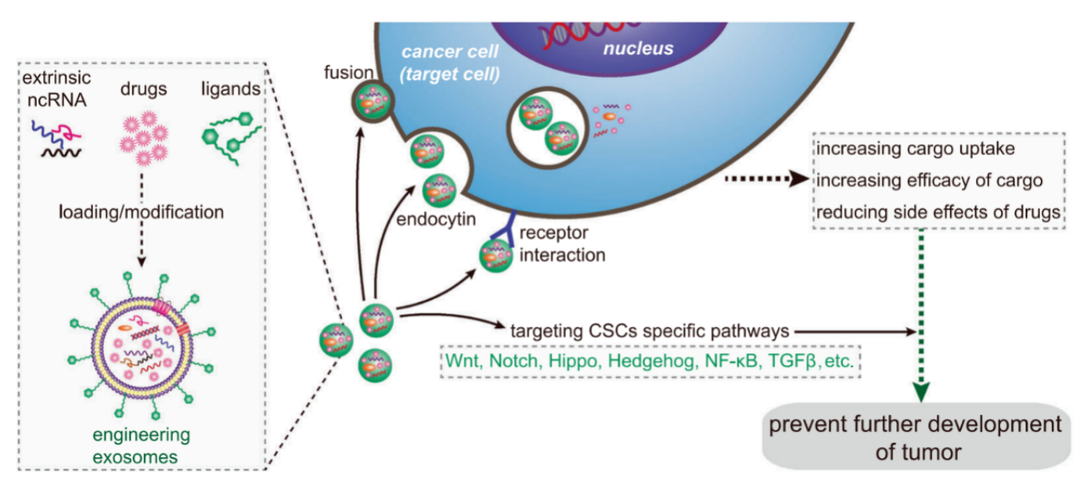
图5.以外泌体为载体,精确靶向治疗肿瘤[3]
基于外泌体microRNA有效地参与靶mRNA并抑制受体细胞中基因表达的观察结果,外泌体工程递送特定的miRNA或小干扰RNA(siRNA)有效负荷已被开发用于CNS疾病和癌症。外泌体RNA可能受到血源性核糖核酸酶的保护而不被降解,与脂质体相比,结合优越的全身滞留,可以使外泌体在远处发挥其功能。使用外泌体递送miRNA或siRNA有效负荷的临床前试验集中于对啮齿类动物的乳腺癌、胶质瘤和胰腺癌治疗,以及探索性脑靶向。使用GE11合成肽修饰的外泌体靶向EGFR + 乳腺癌细胞,并将microRNA let-7a递送至癌细胞,限制了其在体内的生长。MSC来源的外泌体能够在大鼠胶质瘤中传递miR-146b和靶向EGFR。临床级的MSC来源的外泌体与KrasG12D siRNA有效载荷(Exosomes)已被用于治疗多种动物模型中的胰腺癌。
这些研究表明,Exosomes作为单一药物给药,小鼠的总生存期大幅增加,并能够实现特异性靶标结合,而没有任何明显的毒性。研究表明,外泌体上的CD47导致“不要吃我”信号,保护它们免受吞噬作用,限制它们从循环中清除。此外,与癌细胞相关的巨胞饮增强了外源性给予的Exosomes的进入。
总之,这些早期临床数据和大量的临床前研究为开发外泌体作为治疗药物提供了鼓励。
商业资讯:
一系列大型制药公司的交易表明,该行业正在拥抱外泌体,包括外泌体药物、外泌体诊断以及外泌体药物递送等。外泌体可将核酸药物递送至难以到达的组织,从而达到治疗肿瘤及阿斯海默症等神经退行性疾病等目的。2020年仅在6月,礼来、武田和拜耳就宣布了外泌体公司相关的超过10亿美元的交易(表1)[4]。

此外,近年来,一些新兴公司如雨后春笋般涌现,如Aegle Therapeutics、Anjarium Biosciences、Capricor Therapeutics、Creative Medical Technology Holdings、Everkine Corporation、Exogenus Therapeutics、Kimera Labs、Codiak BioSciences、Evox Therapeutics、Exosome Diagnostics、HansaBioMed、NonosomiX 等不少公司正在开发胞外体检测工具、治疗方法或药物载体等产品。胞外体诊断平台除了应用于癌症领域之外,还可望应用于免疫学、心血管疾病、传染病和中枢神经系统疾病在内的许多临床领域,未来有更多以胞外体为主的疾病诊断诊断技术或标靶治疗产品诞生。
参考资料:
1. The biology, function, and biomedical applications of exosomes, Kalluri et al., Science 367, 640 (2020)
2. http://www.exocarta.org
3.Jie Dai, et al.Exosomes: key players in cancer and potential therapeutic strategy,Signal Transduction and Targeted Therap.2020 Aug 5; 5(1): 145.
4. Big pharma buys into exosomes for drug delivery,Nature Biotechnology,2020






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn