近期眼科疾病新药领域好消息频传:3月4日,联邦制药新药RASP抑制剂获CDE批准进入临床,用于干眼症治疗;2月17日,FDA批准了Apellisde公司补体C3环肽抑制剂Pegcetacoplan的上市申请,用于治疗继发于年龄相关性黄斑变性(AMD, dry age-related macular degeneration)的地图样萎缩(GA);2月16日,Iveric Bio宣布其GA疗法 补体C5抑制剂Zimura的新药申请获FDA优先审评。而随着人口老龄化、生活中电子产品的广泛使用等,各类眼部疾病发病率呈逐渐上升趋势。根据弗诺斯特沙利文预测,全球眼科药物市场规模预计到2025年将达到464亿美元,仍需要有效的治疗药物和创新疗法来满足巨大的用药需求。
常见的眼科疾病与药物靶点
常见的眼科疾病包括近视/老视、干眼症、白内障、眼底血管病变、青光眼、结膜炎、视网膜疾病等。2015-2021年期间,共有29种眼科新药获FDA批准上市。目前眼科新药的研究主要集中在年龄相关性黄斑变性、青光眼和视网膜水肿等可以用药物干预治疗的疾病类型。
01、年龄相关性黄斑变性(AMD)
年龄相关性黄斑变性(AMD)是一种视网膜疾病,可在老年人中发展为视力损伤甚至失明,其中80-90%为干性AMD(萎缩型GA),10-20%为湿性AMD(渗出型,也称新生血管性AMD)[1],但90%左右的严重视力丧失是由湿性AMD所致。AMD适应症也成为眼科企业的兵家必争之地,抗血管生成药物和补体系统治疗药物是AMD治疗的主要种类。
1.抗血管生成药物
视网膜中的血管异常生长是AMD的标志,抑制血管有助于减缓疾病发展。主要靶点有VEGF(血管内皮生长因子)、PDGF(血小板衍生生长因子)、FGF(成纤维细胞生长因子)、TSP-1(血小板反应蛋白-1)、ANG2(血管生成素2)、TGF-β(转化生长因子-β)等。此外,弗吉尼亚大学科学家发表在Nature子刊《Signal Transduction and Targeted Therapy》的新研究确定了一种决定VEGF-A水平的关键靶点FTO,研究发现抑制FTO可抑制VEGFA释放和脉络膜新生血管形成,为眼科疾病治疗提供新的思路[2]。

图1 代表性抗血管生成药物及靶点[3]
2.补体系统靶向治疗
补体系统是免疫系统的一部分,可以引起对AMD患者健康细胞的炎症反应和损害。抑制补体途径可以减少炎症发生。补体级联反应由经典途径、替代途径和凝集素途径组成,这三种途径在C3汇聚并向下级联通过C5,使C3和C5成为治疗干性AMD的潜在靶点。此外许多补体激活产物和补体因子,如MAC(膜攻击复合物)、CFB(补体因子B)、CFI(补体因子I)、CFD(补体因子D)等也是可能的治疗靶点。Pegcetacoplan是一款C3补体抑制剂,2月受FDA批准上市成为首款治疗GA的药物,此款药物由补体领域龙头药企Apellis开发,通过抑制C3激活,阻止C3进一步在眼部的沉积。Iveric Bio开发的C5抑制剂Zimura,在两项关键的3期试验中治疗GA有效率达35%,预计8月收到FDA的优先审评结果。
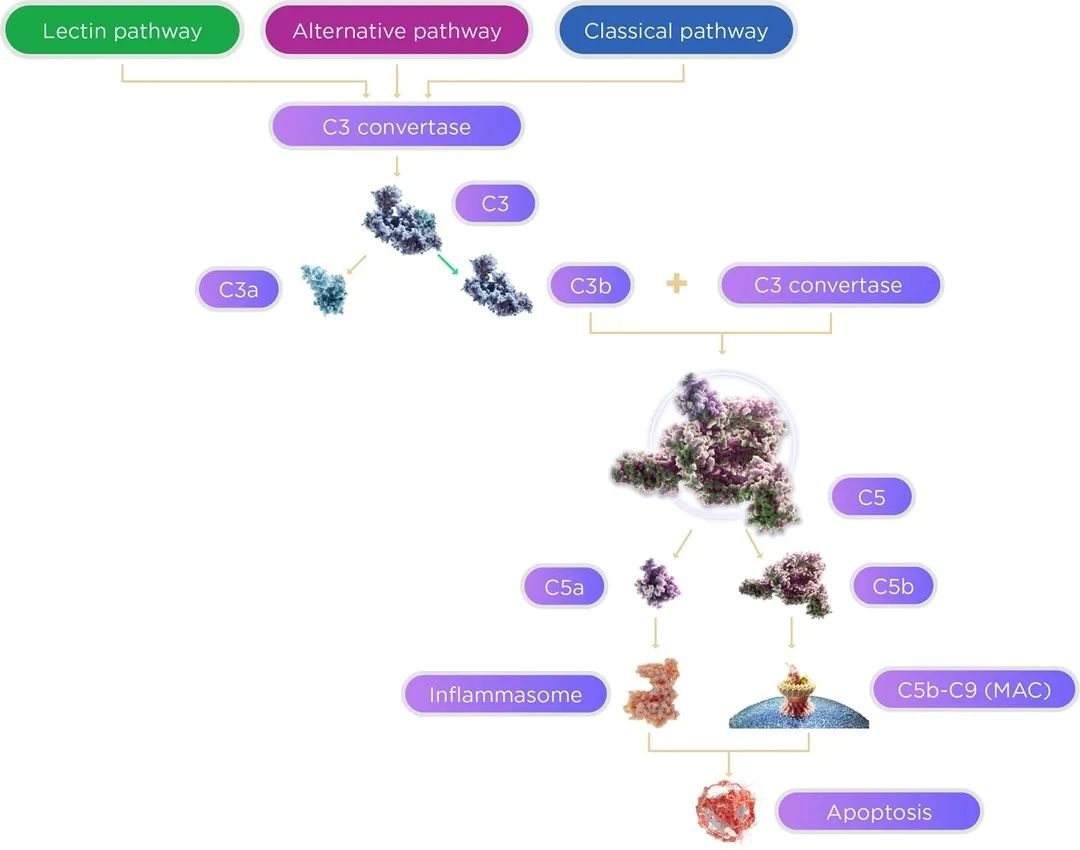
图2 补体级联反应[4]
02、干眼症(DED)
干眼症DED 是最常见的眼部慢性疾病之一,全球患病率约为 5%-50%。干眼症是一种常见的泪液和眼表多因素疾病,表现为与泪液量减少和眼表敏感性降低相关的眼表上皮细胞发生变化,导致炎症反应,中重度的干眼症患者往往需要进行抗炎治疗。
干燥、氧化和高渗透压应激激活眼表细胞信号通路,导致促炎细胞因子(TNF-α、IL-1β和IL-6)和基质金属蛋白酶(如MMP9)的产生。这些因子促进抗原呈递细胞的成熟,使成熟的抗原呈递细胞通过传入淋巴管迁移至淋巴结。在淋巴结中,mAPC诱导效应 T 细胞(Th 1和Th17)并招募它们迁移到眼表。同时,mAPCs激活NLRP3炎性体,促进IL-1β和IL-18的分泌,进一步加重眼表炎症。干眼症在研药物作用靶点丰富,涉及RASP(活性醛化物质)、MCR(黑素皮质素受体)、TNF(肿瘤坏死因子)等。Aldeyra开发的治疗干眼症的新型药物Reproxalap上市申请已获FDA受理,它是一种小分子RASP抑制剂,能够降低RASP水平,缓解严重炎症症状。

图3 干眼症中眼表的免疫炎症反应[6]
布局眼科药物研发企业
国际眼科赛道玩家包括诺华、罗氏、拜耳等跨国药企,艾尔建(艾伯维旗下)、爱尔康、日本参天制药等眼科巨头,基因泰克、再生元等生物技术企业;我国眼科药物研发起步较晚,增速较快,各制药企业及新技术公司争相布局,本文仅列举部分企业。
老牌眼科药企
康弘药业:国内布局眼科用药的先驱,自主研发药物康柏西普填补了国产湿性AMD用药的空白,销售额可观,但海外临床试验受挫,失去了出海的希望。其他治疗眼底疾病的双功能抗体药物在研发中。
欧康维视:中国老牌眼科药企,与多家海外药企合作,在研管线24款药物,包括抗血管内皮生长因子、酪氨酸激酶抑制剂等创新药,覆盖主要眼科疾病。
兆科眼科:由李氏大药厂分拆,港交所上市的第二家眼科药物生物科技公司,管线中包含14款创新药物,针对干眼症的环孢素A凝胶、角膜上皮缺损的胸腺素β功能片段ZKY001,ZK002是一种具有抗炎作用和抗渗透作用新型作用机制的蛋白质,治疗糖尿病黄斑水肿和翼状胬肉。尚无商业化产品。
兴齐眼药:主营产品为国内首个上市治疗干眼症的环孢素滴眼液,眼用凝胶等。
综合型创新药企业
信达生物抗VEGF-补体双靶点抗体用于新生血管性年龄相关性黄斑变性,目前II期临床阶段;荣昌生物RC28-E是VEGF/FGF双靶点融合蛋白,治疗湿性AMD、糖尿病黄斑水肿(DME)和糖尿病性视网膜病变(DR),正在进行II/III期临床研究;恒瑞医药2019年引进两款治疗干眼症药物,进军眼科用药市场。
新兴眼科新药企业
典晶生物:聚焦重组人胶原蛋白技术,管线中EB-301进展最快处于临床III期阶段,是生物合成角膜,EB-105 和 EB-110 是用于治疗DME和湿性AMD的候选产品。
维眸生物:4款眼科药物,主要布局干眼症和青光眼。VVN01是LFA1抑制剂用于治疗干眼症的创新药;VVN539是ROCK激酶抑制剂及NO(一氧化氮)释放促进剂的双机制小分子降眼压药物,处于临床阶段。
纽福斯生物:基因治疗领域眼科药物进展最快的企业,核心产品NFS-01(rAAV2-ND4),用于治疗ND4突变引起的Leber遗传性视神经病变(ND4-LHON)。产品管线包含针对遗传性视神经萎缩、视神经损伤疾病、血管性视网膜病变等多种眼科疾病的10余个在研项目。
极目生物:产品管线涉及诊断、治疗和日常眼保健等药械相结合,拥有引进的微矩阵药膜专利技术,避免传统给药弊端。布局干眼症、糖尿病黄斑水肿、青光眼等疾病。
因明生物:研究范围涵盖眼科药物、重组蛋白肉毒素、小分子免疫药物和细胞治疗等多个领域,目前有三款眼科药物,用于治疗干性年龄相关性黄斑变性和蠕形螨睑缘炎的小分子药物。
拨云制药:眼科新锐,具有小分子多激酶抑制剂技术平台和抗体-小分子协作偶联技术平台,核心产品CBT-001(多激酶抑制剂局部滴眼液)作为国际首创新药治疗翼状胬肉,阻断VEGFR、PDGFR、FGFR信号通路,药物进入临床III期阶段。其他6款药物,2款在临床阶段,4款在临床前开发中。
锐明新药:小分子眼科新药研发公司,22年完成新一轮亿元融资,专注于眼底疾病的药物递送技术。
百奥动物眼科疾病相关靶点人源化小鼠列表
新兴眼科新药企业百花齐放,布局靶点广泛,百奥动物开发了一系列靶点人源化小鼠,可助力眼科靶点药物开发进程。
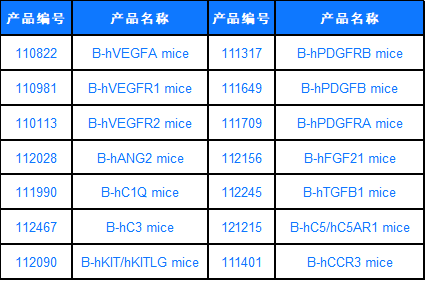
更多动物模型,请访问www.biomice.com.cn查询
参考资料
[1] iménez-Gómez Y, Alba-Molina D, Blanco-Blanco M, Pérez-Fajardo L, Reyes-Ortega F, Ortega-Llamas L, Villalba-González M, Fernández-Choquet de Isla I, Pugliese F, Stoikow I, González-Andrades M. Novel Treatments for Age-Related Macular Degeneration: A Review of Clinical Advances in Sustained Drug Delivery Systems. Pharmaceutics. 2022 Jul 15;14(7):1473.
[2] Wang, Sb., Nagasaka, Y., Argyle, D. et al. Targeting the m6A mRNA demethylase FTO suppresses vascular endothelial growth factor release and choroidal neovascularization. Sig Transduct Target Ther 8, 72 (2023).
[3]Tosi, Gian Marco; Barbarino, Marcella; Orlandini, Maurizio; Galvagni, Federico (2017). New molecular targets for the treatment of neovascular age-related macular degeneration. Translational Medicine Reports, 1(3).
[5]Thomas, C. N., Sim, D. A., Lee, W. H., Alfahad, N., Dick, A. D., Denniston, A. K., & Hill, L. J. (2022). Emerging therapies and their delivery for treating age-related macular degeneration. British Journal of Pharmacology, 179( 9), 1908– 1937.
[6] Ling Jiawei, Chan Ben Chung-Lap, Tsang Miranda Sin-Man, Gao Xun, Leung Ping Chung, Lam Christopher Wai-Kei, 2022. Hu Jiang-Miao, Wong Chun Kwok. Current Advances in Mechanisms and Treatment of Dry Eye Disease: Toward Anti-inflammatory and Immunomodulatory Therapy and Traditional Chinese Medicine. Frontiers in Medicine,8.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn