动物行为学是研究动物对环境和其他生物的互动等问题的学科,研究的对象包括动物的沟通行为、情绪表达、社交行为、学习行为、繁殖行为等。动物行为学实验是动物整体生理和心理状态综合、全面和实时效应的反应,通过实验,科研人员可以评估动物的各项生理和心理状态,从而探索认知、情绪和运动等复杂的生命现象。
在许多研究中都会用到疾病动物模型,这些疾病动物模型常结合动物行为学实验来探索发病机制、药理药效等,因此动物行为学实验在生物医药领域具有不可替代的地位和作用。
动物行为学实验平台
百奥动物药理药效部动物行为学实验平台,可为客户提供多种动物行为学实验服务,有效支持发病机制研究、创新药物研发、药物安全和风险监测等。下边我们来了解一下百奥动物可以提供的部分动物行为学实验吧。
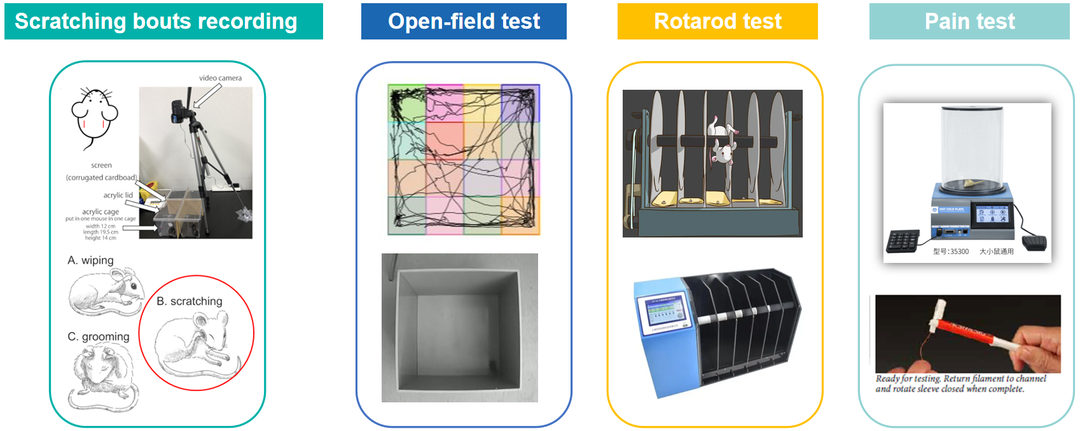
动物行为学实验平台可提供实验服务
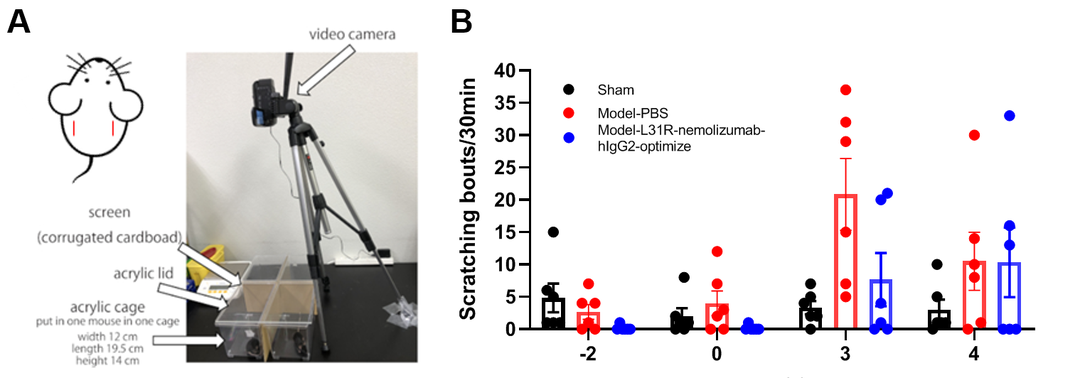
01、抓痒行为实验
抓痒行为实验可以评估以瘙痒为主要症状的多种皮肤病模型,支持相关药物研究。
hIL-31诱发瘙痒的过程流程图
抓痒记录标准:老鼠抬起一条后腿朝向脸颊、背部和耳朵,在一秒或几秒钟内抓痒几次,然后放下那条腿。这一系列动作计为一次抓痒。

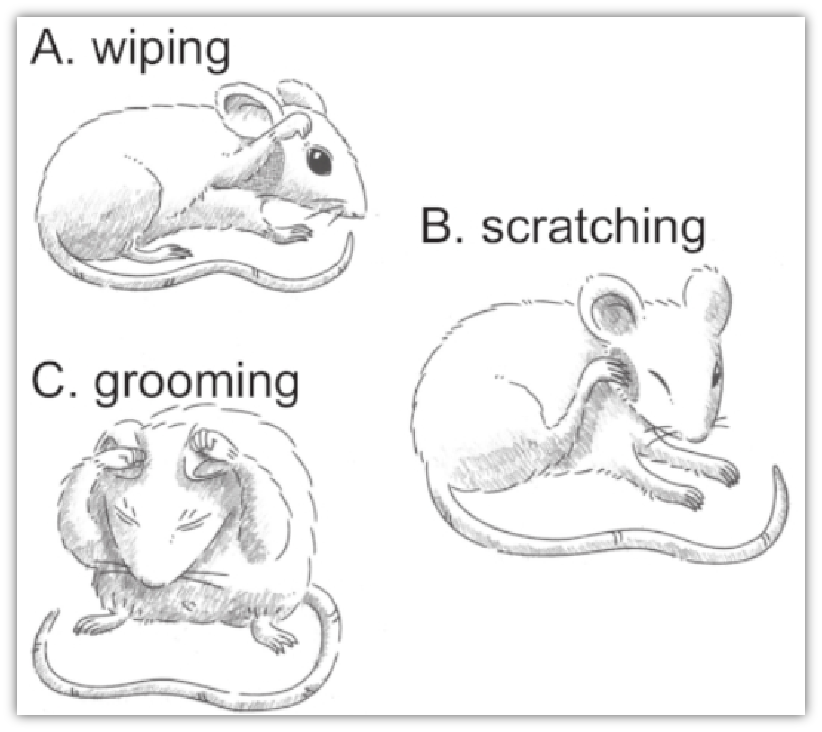
抓痒实验示意图[1]
抗人IL31R抗体 (Nemolizumab) 在瘙痒症模型中的药效
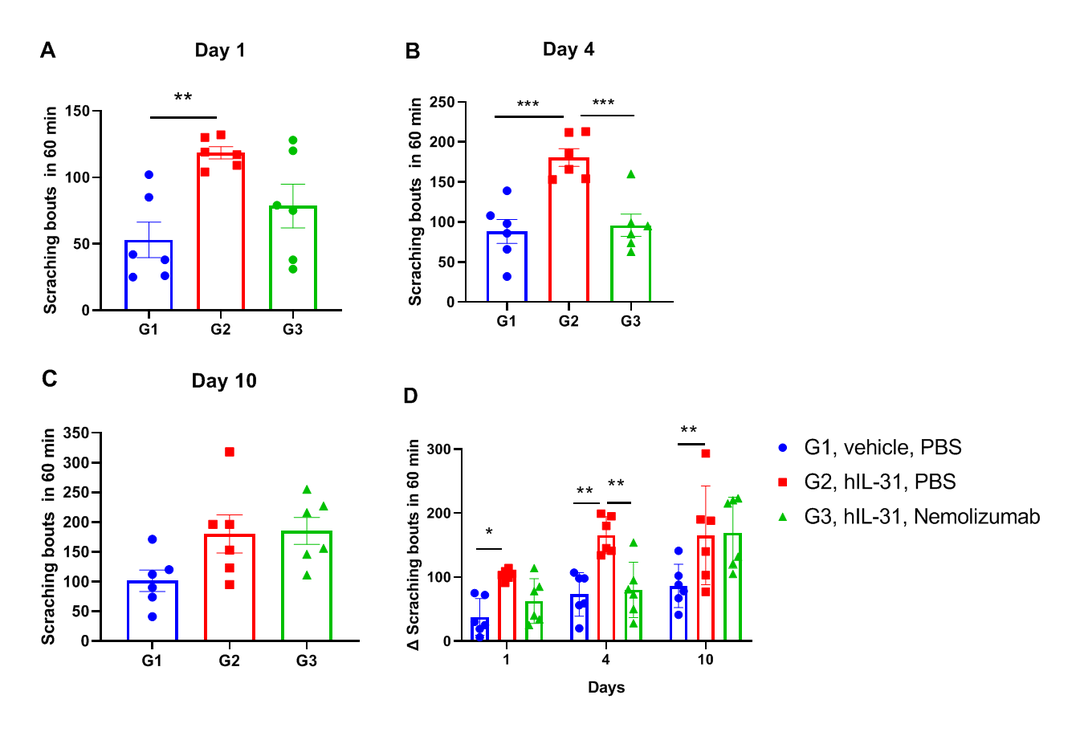
(A)第1天小鼠抓痒数据统计;(B)第4天小鼠抓痒数据统计;(C)第10天小鼠抓痒数据统计;(D)不同天不同组小鼠抓痒频率增加的汇总。
小鼠伤口愈合模型中的抓痒实验
实验动物:C57BL/6,BALB/c,人源化小鼠,5-6周龄,雌性
建模方法:创伤
数据分析:抓痒记录,IHC,ELISA
(A)B-hIL31/hIL31RA/hOSMR小鼠在第0天接受等距1cm全层切口创伤。(B)抓痒记录。
MC903诱导的AD模型中的抓痒实验
实验动物:C57BL/ 6,8周,雌性
建模试剂:MC903
造模方法:小鼠右耳涂敷MC903

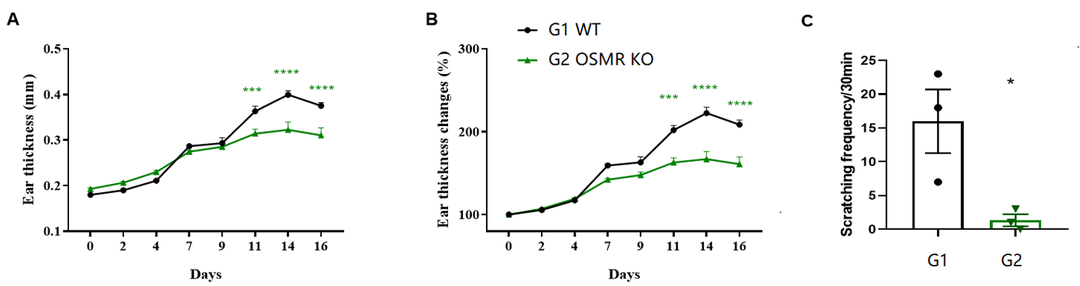
(A)耳朵厚度;(B)耳朵厚度变化;(C)抓痒记录。
02、旷场实验
旷场实验和其延伸实验可用于评价实验动物的运动能力、在新异环境中自主行为、焦虑程度和记忆学习能力等
实验前准备事项
- 实验尽量仅在上午或者仅在下午进行以减少昼夜节律影响
- 实验开展当天对动物进进行称重
- 试验开展前,动物需要提前一个小时挪至实验房间适应环境 (黑暗环境)
- 动物实验操作员尽量保持同一人。
- 实验在黑暗或弱光环境完成,实验房间需要保持安静。
- 实验前一天给小鼠画好尾巴标记,实验当天尽量不要保定小鼠查看耳号。
- 实验前调试软件设置不能用检测鼠,需要用分剩鼠。
实验操作过程
- 实验前用75%酒精对实验设备和操作人员的手进行彻底消毒,待酒精干透后进行实验。。
- 设置软件,16宫格,标记角落,四边,中心等区域设置。
- 实验开始前,测量并记录旷场底部亮度和噪音水平。
- 轻轻托起小鼠(可以用称体重用的小盒子做转移盒,尽量不要提着尾巴或者保定小鼠造成压力),小鼠头部背向操作人员,将小鼠放置于旷场中央,实验员离开房间。
- 录像10 min,软件统计总距离, 平均运动速度,在中心,四边,与四角时间,四边和中心区域的穿越次数,人工统计排泄次数(尿+粪便数)。
- 实验完成后,将小鼠放至新的笼盒,不要放回至还有未进行实验的小鼠的原鼠笼。酒精清理实验箱和转移盒,操作员双手酒精消毒, 等待酒精干透后进行下一组实验。

旷场实验
基于EAE模型进行旷场实验
实验动物:C57BL/6J,8-9w,雌性
EAE模型:MOG乳剂诱导轻度实验性自身免疫性脑脊髓炎模型
实验分组:
G1-PBS;
G2-CFA自制;
G3-commercial CFA
试验方案:10分钟自由探测(AT D21)
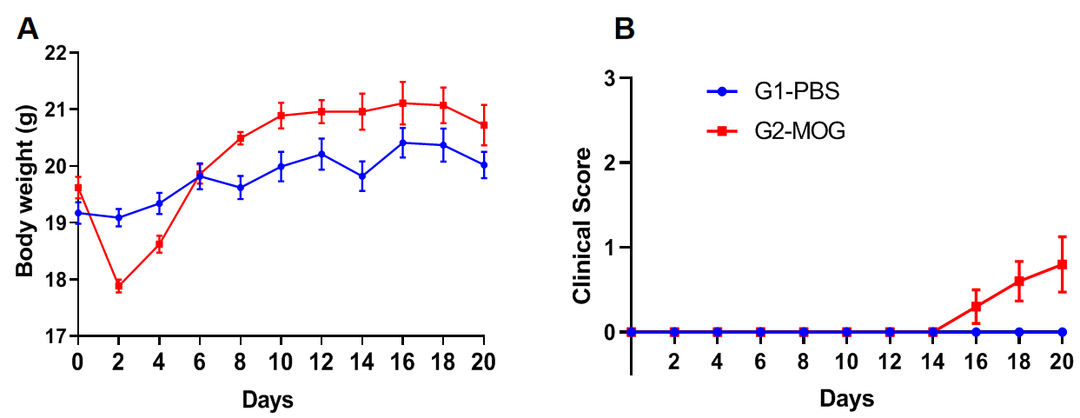
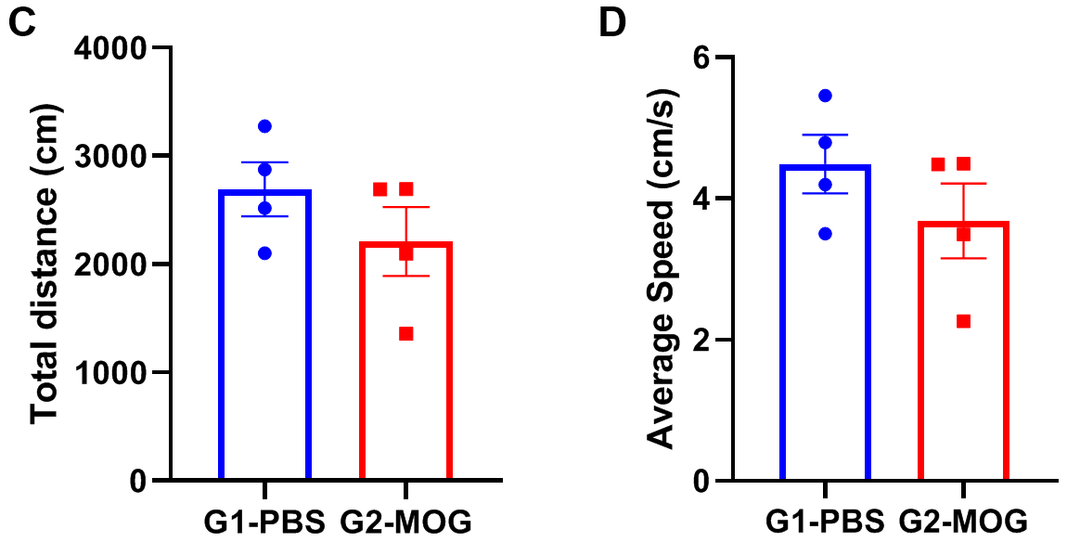
(A)体重;(B)临床评分;(C)总距离;(D)平均速度。
03、转棒实验
转棒测试用于评估啮齿动物的运动协调、平衡、疲劳程度等。
实验前准备事项
- 同一周内,若动物也需要进行旷场实验,转棒实验应在旷场实验开展后进行。
- 开展实验当天对动物进行称重。
- 动物实验操作员尽量保持同一人。
- 试验开展前,动物需要提前一个小时挪至实验房间适应环境。
- 若需进行多组试验,实验光照需要保持恒定。
- 正式实验前对动物训练,需要测试三种训练方式:
a.上午10rpm匀速训练5分钟;下午35rpm/min匀速训练5分钟;期间动物如果坠落,立即放回转棒即可,记录每只动物在训练期间坠落的次数。
b.实验前一天进行如下训练: 3*10rpm匀速训练5分钟,注意同一只动物每次训练间需要30分钟以上休息时间,期间动物如果坠落,立即放回转棒即可,记录每只动物在训练期间坠落的次数。
c.实验进行当天动物进行5分钟5rpm的匀速训练,期间动物如果坠落,立即放回转棒即可,记录每只动物在训练期间坠落的次数。
实验操作过程
- 实验前用75%酒精完全消毒实验仪器, 实验员消毒双手,待酒精干透后进行实验。
- 设置实验参数:目前有两种方式需要测试:
a:5rpm*1min→3rpm/min acc→40rpm*5min
b:5rpm*1min→8rpm/min acc→45rpm*1min
- 将小鼠放置于杆上,尽量采取不同组小鼠同时测试的方式放鼠(例:一次试验中,各组别分别取一只进行检测)。在接触不同笼子里的动物时,要消毒双手。当所有的动物都被正确地放置在杆上后,打开预设程序。
- 实验结束后,机器会自动统计小鼠从杆上掉落的潜伏期,掉落时速度,运动距离,人工根据录像统计小鼠掉落状态(坠落,跳跃或其他)。
- 每只小鼠重复实验三次,取平均值,注意每只鼠重复实验间隔至少30分钟,防止小鼠过度疲劳。
- 实验完成后,根据分组,将小鼠放至新的笼盒,不与未测试动物接触。用75%酒精小鼠实验仪器以及操作员双手, 等待酒精干透后进行下一组实验。
训练对转棒实验结果的影响

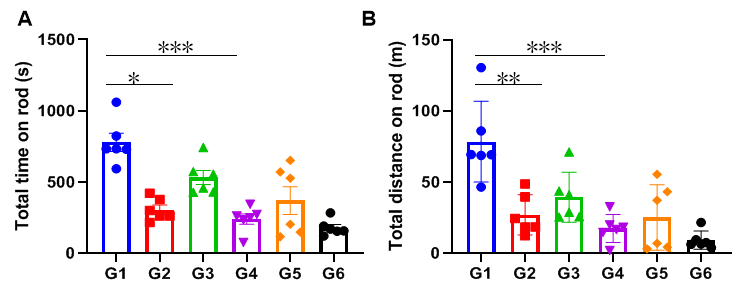
(A)在杆上运动总时间;(B)在杆上运动总距离。
基于轻度EAE模型的转棒实验
实验动物:C57BL/6J,8-9周,雌性
实验分组:
G1-PBS;
G2-CFA自制;
G3-commercial CFA
EAE模型:MOG乳剂诱导轻度实验性自身免疫性脑脊髓炎模型
训练方法:b.测试前一天:10rpm*5min*3 (D21)
测试方法:A.5rpm*1min→3rpm/min→40rpm*5min (AT D22)
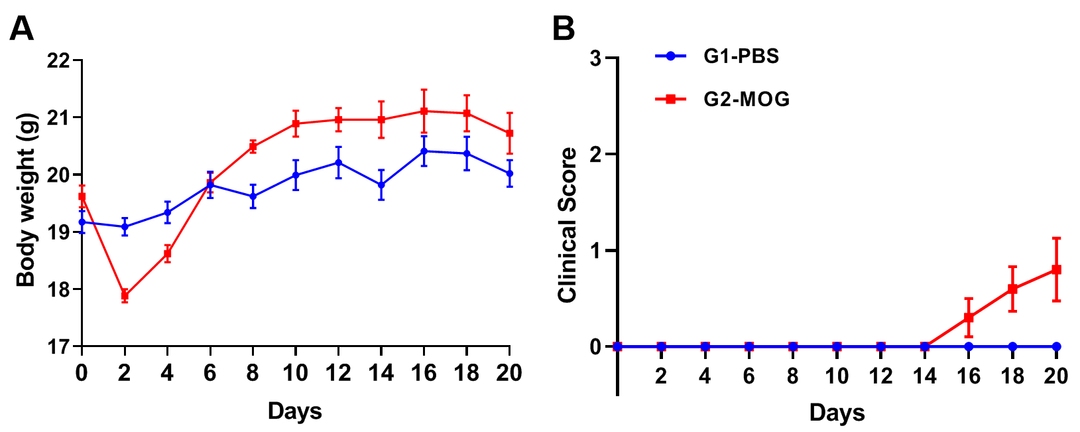

(A)体重;(B)临床评分;(C)每轮训练中掉落次数;(D)掉落潜伏时间;(E)掉落时速度;(F)总行进距离。
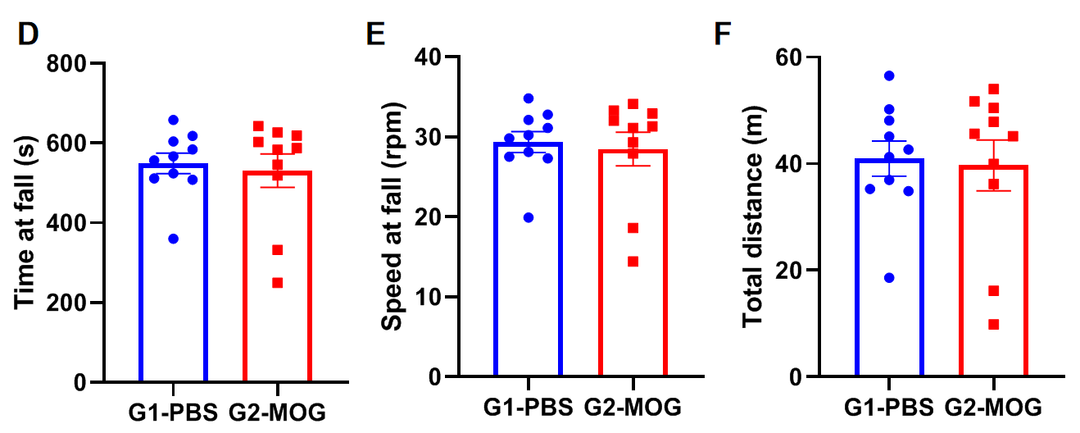
对麻醉动物进行转棒实验
实验动物:C57BL/6J, 7-8周,雌性
实验分组:
G1-15mg/kg Zoletil®50+1.5mg/kg Xylazine hydrochloride;
G2-7.5mg/kg Zoletil®50+0.75mg/kg Xylazine hydrochloride;
G3-3.75mg/kg Zoletil®50 +0.375mg/kg Xylazine hydrochloride;
G4-control;
训练方法:b.测试前一天:10rpm*5min*3
测试方法:A.5rpm*1min→3rpm/min acc→40rpm*5min
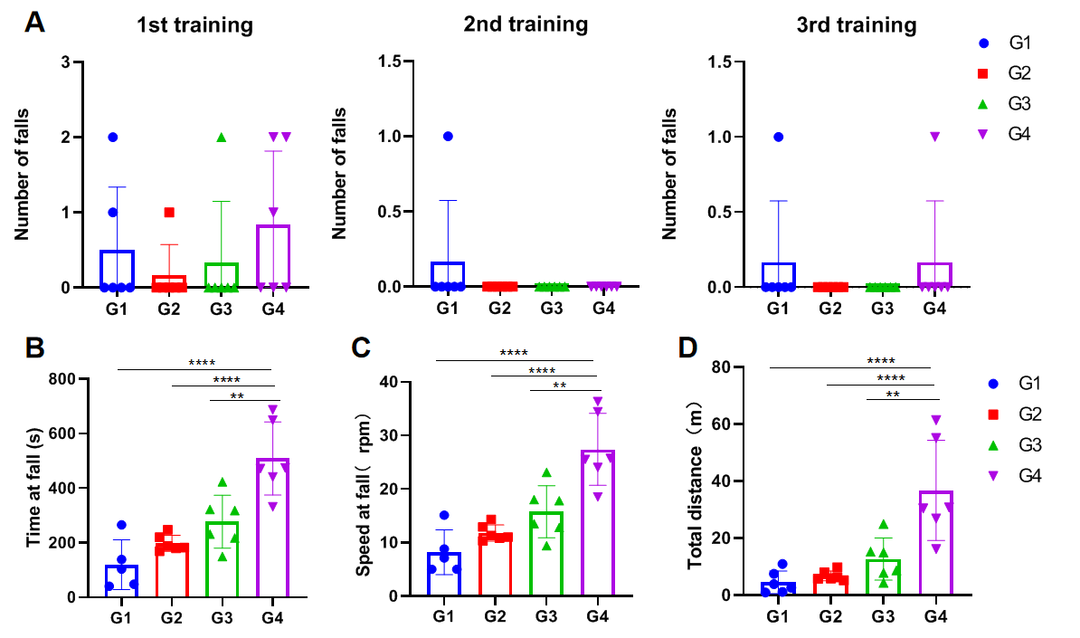
(A)每轮训练中掉落次数;(B)掉落潜伏时间;(C)掉落时速度;(D)总行进距离。
参考资料:
[1].J Vis Exp. 2019 Sep 27;(151). doi: 10.3791/58943.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn