随着药物研发对大鼠及其相关动物模型需求的增加,大鼠成瘤及药效在药物研发领域的潜力会越来越大。相较于小鼠,大鼠生理学与人类更加相似,大鼠也非常适合进行手术、需要连续抽血的药物研究、移植研究等
实验大鼠类型
常见的大鼠类型包括Wistar大鼠、SD大鼠、F344大鼠等。
1、Wistar大鼠
1907年由美国维斯塔尔(Wistar)研究所育成,现已遍及世界各国的实验室。Wistar大鼠毛色白色,性情温顺,繁殖力强,产仔多,平均每胎产仔在10只左右,生长发育快,10周龄时雄鼠体重可达280-300g,雌鼠达170-260g,目前各地饲养的Wistar大鼠的遗传状况差异较大,既有近交系也有远交群。
2、SD大鼠(Sprague Dawley, SD)
1925年美国斯泼累格·多雷(Sprague Dawley)农场用Wistar大鼠培育而成。SD大鼠的毛色也是白色,性情比Wistar大鼠稍为凶猛,生长发育比Wistar大鼠快,10周龄时雄鼠体重可达300-400g,雌鼠达180-270g。
3、Fisher 344大鼠
即F344大鼠,1920年在哥伦比亚大学肿瘤研究所问世,因其旋转运动性低,血清胰岛素含量低,原发和继发性脾红细胞免疫反应性低,乳腺癌、脑垂体腺瘤、甲状腺瘤、睾丸间质细胞瘤发病率高,多用于毒理学、肿瘤学、生理学等领域的研究。
表1 常见大鼠品系对比
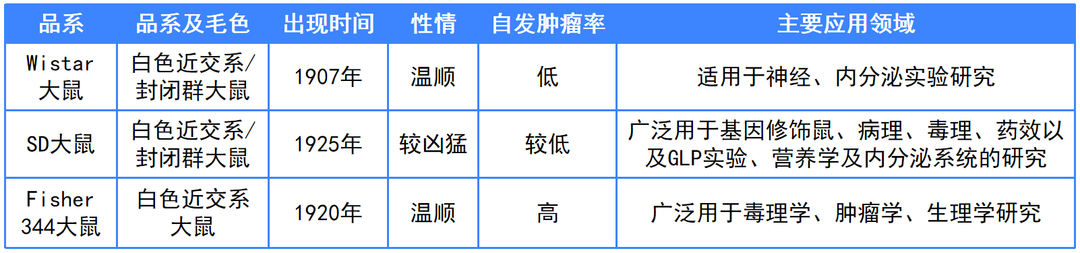
如表1中显示,以上三种常见大鼠中只有F344大鼠的自发肿瘤率较高,也成为许多成瘤实验的模型动物。
大鼠模型优势及主要应用领域
大鼠模型优势
1、基因水平
大鼠基因组大约有 27.5 亿个碱基对,小于人类基因组的 29 亿个碱基对,略大于小鼠基因组的 26 亿个碱基对,几乎所有已知与疾病相关的人类基因在大鼠基因组中都能找到对应基因,并且在哺乳动物进化过程中显得高度保守。
2、体型
大鼠与人类的生理具有很高的相似性,成年大鼠的体重是成年小鼠的十倍左右,大鼠手术通常更容易,手术造成的组织损伤也更少,并且大鼠可以比小鼠携带更大重量的移植物,另一方面,大鼠更适合连续样本收集,比如抽血等操作。
3、行为
大鼠在进行操作时相较于小鼠更容易处理并且表现出更少的应激反应,大鼠社交性也较小鼠更强,在学习认知方面更为出色,与人类行为更为接近。
大鼠模型的主要应用领域
大鼠的主要应用领域包括在心血管疾病、糖尿病、营养代谢病、乳腺癌、关节炎、神经科学、药物研发与毒理药理学研究等。
例如:自发高血压大鼠模型(SHR)在很多方面与人类高血压相似,如遗传因素、发病机制、高血压心血管并发症、对盐敏感性等,已广泛应用于原发性高血压及抗高血压药物筛选等研究;GK大鼠成为研究β细胞衰竭与II型糖尿病之间相互联系的模型;大鼠对用佐剂诱导关节炎异常敏感,除了注射经典的完全弗氏佐剂外,注射不含分枝杆菌的矿物油和纯佐剂,会在许多大鼠品系中诱发严重的关节炎,模拟慢性复发性疾病过程。
免疫缺陷大鼠
大鼠一直是毒理学研究与药物安全性评价的常用动物模型。随着基因编辑手段在大鼠中的应用不断深入,有越来越多的基因工程大鼠模型参与到药物的临床前药效评价与安全性评价中,例如:基因敲除大鼠模型、免疫缺陷大鼠模型、人源化大鼠模型等等。
表2 不同免疫缺陷大鼠模型的比较图片

在表2中列出了主要的免疫缺陷大鼠模型,以及这些大鼠的免疫缺陷程度及特点等信息,其中百奥赛图研发了B-SDG rats(原名B-Rag2/Il2rg KO rats),这种大鼠可用于许多领域的研究,包括免疫系统缺陷、病毒学研究、炎症研究、癌症研究、异种移植物/移植宿主等。
B-SDG rats
B-SDG大鼠是在SD大鼠中敲除了Rag2和Il2rg得来的,其中重组激活基因2(Rag2)在V(D)J重组的启动过程中,在免疫球蛋白和T细胞受体分子的基因重排中起着重要作用。Rag2蛋白的缺失导致没有成熟的T细胞和B细胞,这是适应性免疫系统的关键组成部分。Il2rg被称为白细胞介素受体共同γ链,是许多白细胞介素受体的重要亚基,包括IL-2、IL-4、IL-7、IL-9、IL-15和IL-21,该基因的突变会导致X连锁严重联合免疫缺陷(X-SCID)。
B-SDG大鼠部分检测数据展示
B-SDG 大鼠的胸腺和脾脏的大小与重量
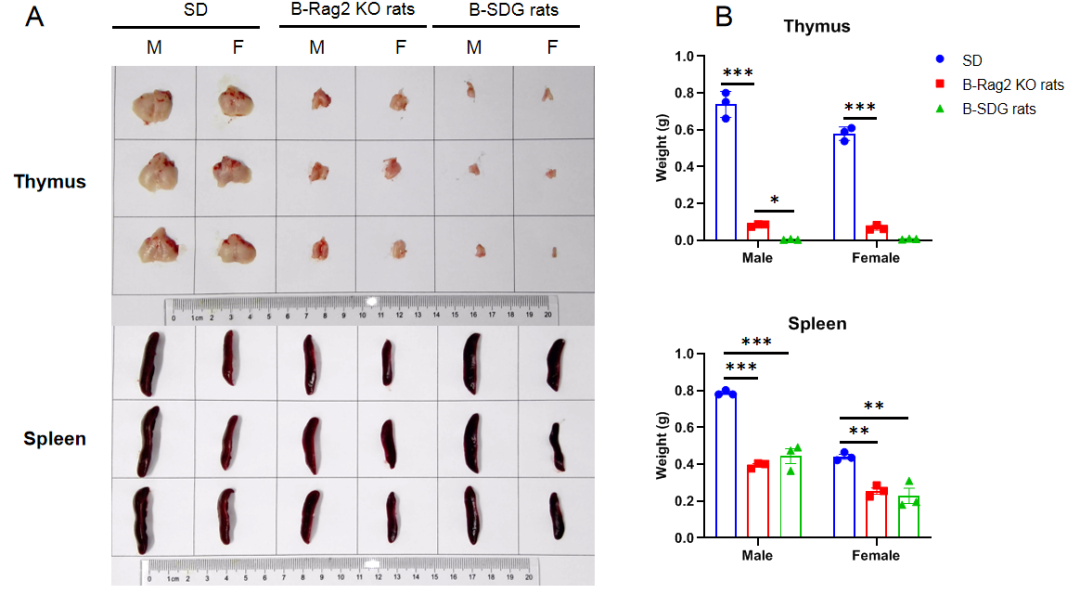
与野生型SD大鼠相比, B-SDG大鼠的胸腺大小和重量显著减小,脾脏大小和重量也同样显著降低。
B-SDG 大鼠的胸腺中T细胞检测
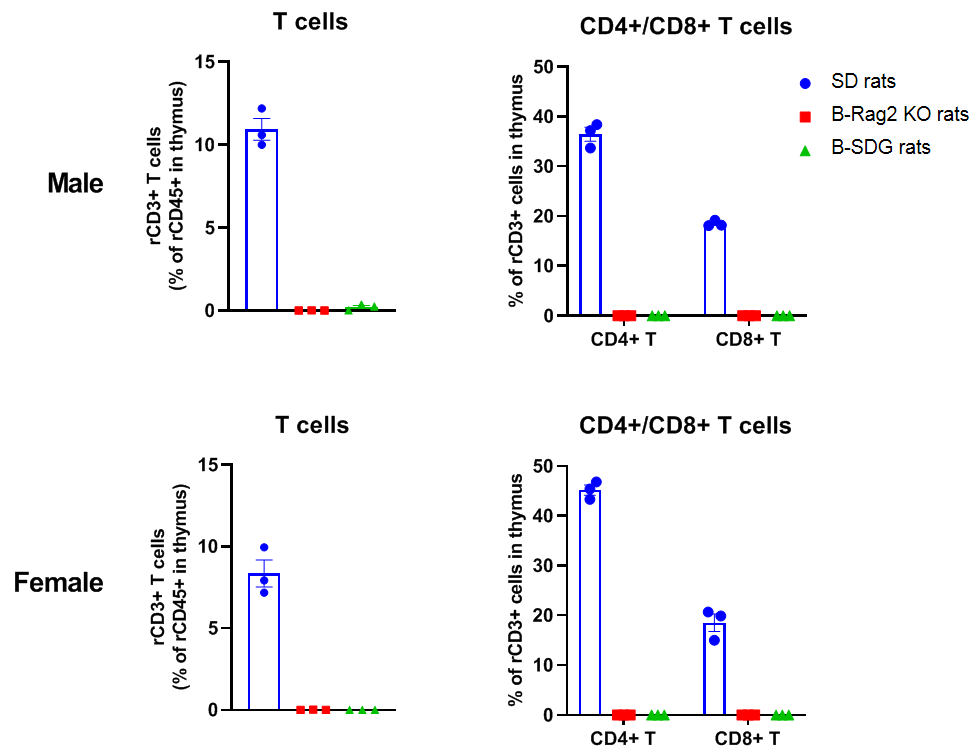
总T细胞、CD4+T细胞和CD8+T细胞仅在野生型SD大鼠的胸腺中可检测到,但无论在雌性还是雄性B-SDG大鼠的胸腺中未检测到T细胞。
B-SDG 大鼠的脾脏中免疫细胞检测
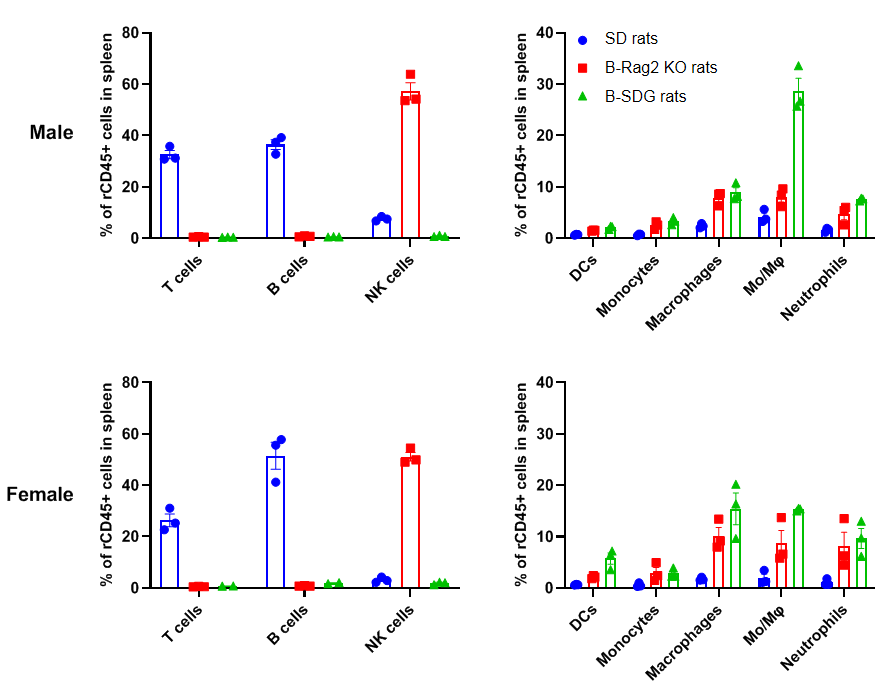
在B-SDG大鼠的脾脏中未检测到T细胞、B细胞和NK细胞,B-SDG大鼠的DC、CD11b+CD43+单核细胞、CD11b+CD68+巨噬细胞、CD11b-CD43+CD68+单核细胞/巨噬细胞(Mo/Mφ)和中性粒细胞的百分比相对高于野生型SD大鼠。
B-SDG 大鼠的血液中免疫细胞检测
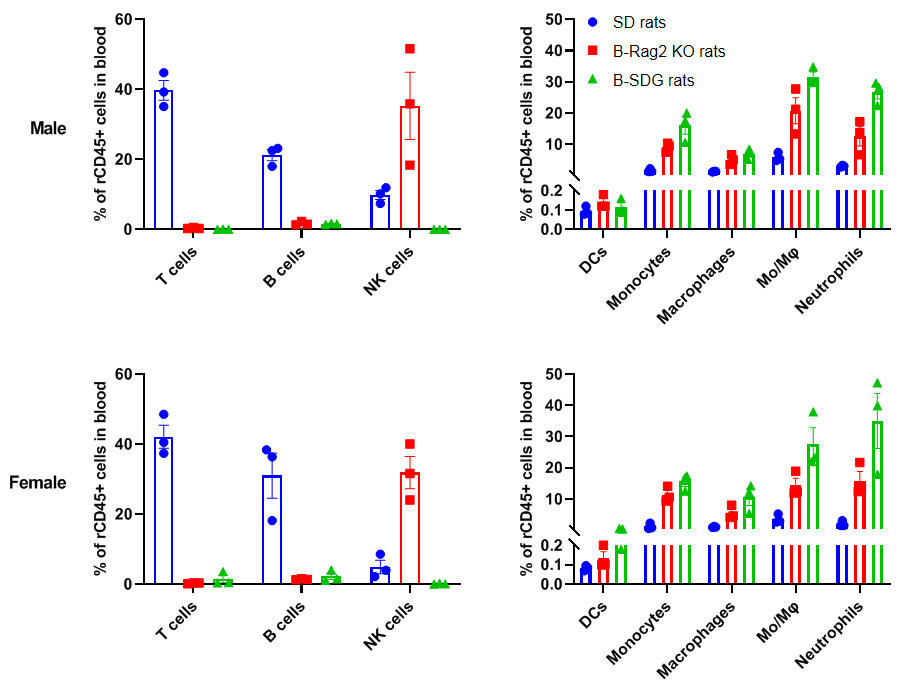
在B-SDG大鼠的血液中未检测到T细胞、B细胞和NK细胞,B-SDG大鼠的DC、CD11b+CD43+单核细胞、CD11b+CD68+巨噬细胞、CD11b-CD43+CD68+单核细胞/巨噬细胞(Mo/Mφ)和中性粒细胞的百分比同样相对高于野生型SD大鼠。
B-SDG大鼠部分成瘤及药效数据展示
B-SDG 大鼠成瘤实验
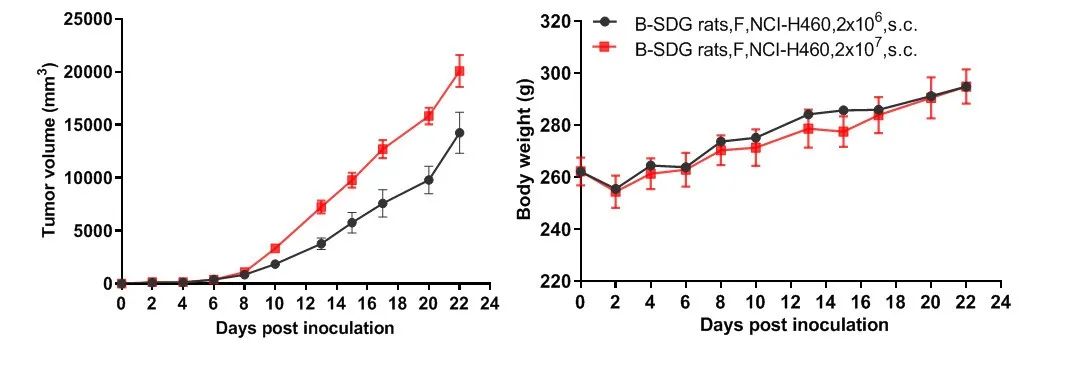
选取9周龄的B-SDG雌性大鼠,根据体重平均分到每组6只,共2组,在大鼠右侧背部皮下接种人肺癌细胞NCI-H460细胞,接种量分别为2×106个和2×107个,与基质胶1:1混合后总体积为0.5 mL,结果显示:NCI-H460细胞能在B-SDG大鼠上成瘤。

选取9周龄的B-SDG雌性大鼠,根据体重平均分到每组6只,共2组,在大鼠右侧背部皮下接种人胰腺癌细胞MIA PaCa-2细胞,接种量分别为2×106个和2×107个,与基质胶1:1混合后总体积为0.5 mL,结果显示:人胰腺癌细胞MIA PaCa-2细胞能在B-SDG大鼠上成瘤。
B-SDG 大鼠NCI-H460肺癌模型中Cisplatin的药效
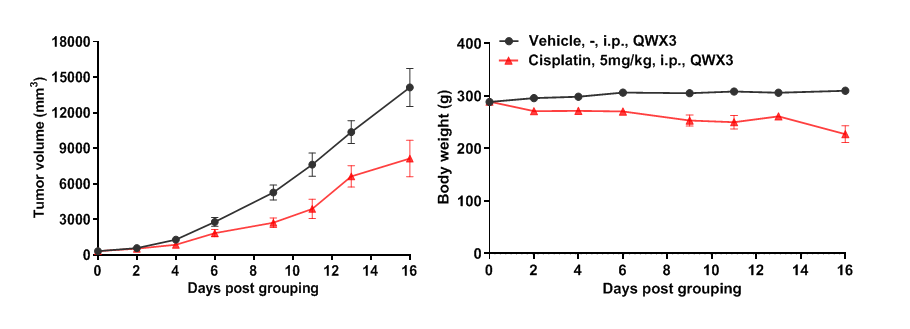
选取9周龄的B-SDG雌性大鼠,在大鼠右侧背部皮下接种人肺癌细胞NCI-H460细胞,接种量分别为2×106个,与基质胶1:1混合后总体积为0.5 mL。接种后第5天,肿瘤平均体积为332mm3时,根据肿瘤体积平均分为2组,每组入组数量为6只,对于实验组给予5mg/kg剂量的Cisplatin,一周一次,总共三次,如图7所示,Cisplatin能够抑制NCI-H460肺癌细胞在B-SDG大鼠上的生长,分组后第16天肿瘤体积抑制率可达43.4%。
B-SDG 大鼠NCI-H1975肺癌模型中ADC药物药效
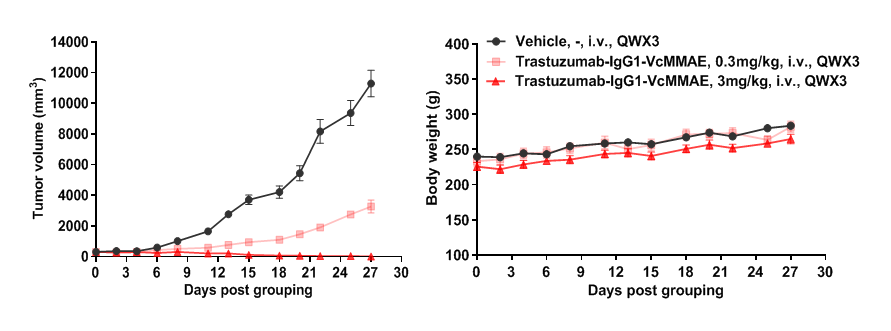
在B-SDG大鼠上接种人肺癌细胞NCI-H1975细胞。接种后第3天,肿瘤平均体积为308mm3时,根据肿瘤体积平均分为3组,每组入组数量为6只,对于实验组分别给予0.3mg/kg和3mg/kg剂量的ADC药Trastuzumab-IgG1-VcMMAE,一周一次,总共三次,如图8所示,该ADC药能够剂量梯度依赖性抑制NCI-H1975肺癌细胞在B-SDG大鼠上的生长,分组后第27天肿瘤体积抑制率分别为73.0%和102.7%。
B-SDG 大鼠NCI-H1975肺癌模型ADC药的PK检测
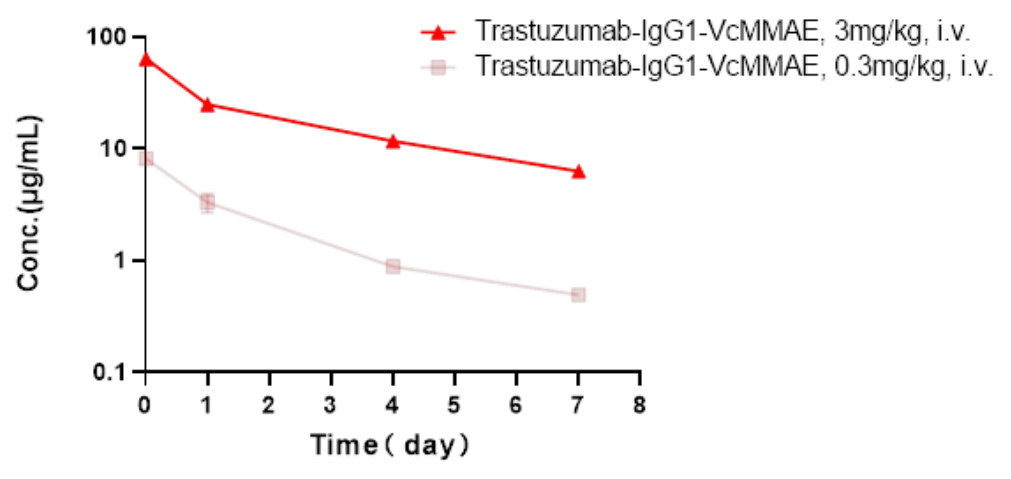
肺癌模型ADC药的药效实验中,在最后一次给药后15min,24小时,第4天以及第7天分别进行采血,做PK检测,结果显示:抗体血药浓度给药后第7天降到较低的水平。
综上所述,一方面,B-SDG大鼠可以接种人源肿瘤细胞系做成瘤以及相关小分子或者抗体药的药效,可能在免疫缺陷小鼠上难以成瘤的人源肿瘤细胞系成瘤实验中具有一定潜力;另一方面,大鼠的体重10倍大于小鼠的体重,可允许的采血量和采样量同样大于小鼠很多,在做成瘤药效实验的同时,可进行足量的采血进行同步血药浓度检测,对于相关科学研究提供了更多的便利和可操作性。
百奥赛图已研发了B-nude rats、B-IL2rg KO rats、B-Rag2 KO rats以及B-SDG rats等免疫缺陷大鼠模型,已具备在大鼠上开展成瘤以及药效服务的能力。如进行人源肿瘤细胞系移植成瘤,开展小分子化药及ADC药等受试品的药效验证,同时且具备在大鼠上开展药物PK相关检测服务能力。
参考文献:
[1] Mashimo T, Takizawa A, Kobayashi J, et al. Generation and characterization of severe combined immunodeficiency rats. Cell Rep. 2012 Sep 27;2(3):685-94.
[2] Noto FK, Adjan-Steffey V, Tong M, et al. Sprague Dawley Rag2 -Null Rats Created from Engineered Spermatogonial Stem Cells Are Immunodeficient and Permissive to Human Xenografts. Mol Cancer Ther. 2018;17 (11):2481-2489.
[3] Yang X, Zhou J, He J, et al. An Immune System-Modified Rat Model for Human Stem Cell Transplantation Research. Stem Cell Reports. 2018;11 (2):514-521.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn